
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X(g)+3Y(g)?2Z(g),其平衡常数为1600 (L/mol)2 | |
| C. | 增大压强,平衡常数增大 | |
| D. | 改变温度可以改变此反应的平衡常数 |
分析 A.转化率=$\frac{浓度变化量}{起始浓度}$×100%计算;
B.化学计量数之比等于浓度变化量之比,而△c(X):△c(Y):△c(Z):=0.05:0.15:0.1=1:3:2,则反应的方程式为X+3Y?2Z,平衡常数K=$\frac{{c}^{2}(Z)}{c(X)•{c}^{3}(Y)}$;
C.增大压强平衡向气体体积减小的方向移动,平衡常数只受温度影响;
D.温度改变后,平衡发生移动,则平衡常数会改变.
解答 解:A.反应达到平衡时,X的转化率为:$\frac{0.1mol/L-0.05mol/L}{0.1mol/L}$×100%=50%,故A正确;
B.化学计量数之比等于浓度变化量之比,而△c(X):△c(Y):△c(Z):=0.05:0.15:0.1=1:3:2,则反应的方程式为X+3Y?2Z,平衡常数K=$\frac{{c}^{2}(Z)}{c(X)•{c}^{3}(Y)}$═$\frac{0.{1}^{2}}{0.05×0.0{5}^{3}}$=1600,故B正确;
C.平衡常数只受温度的影响,温度不变,该反应的平衡常数不变,故C错误;
D.改变温度后,该平衡移动发生移动,则改变温度可以改变此反应的平衡常数,故D正确;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握化学平衡常数的概念及表达式,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
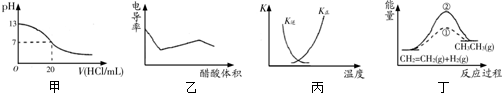
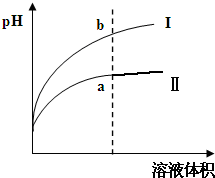
| A. | 甲表示25℃时用0.1 mol/L的盐酸滴定20 mL 0.1 mol/L KOH溶液,溶液的pH随加入盐酸体积的变化 | |
| B. | 乙表示醋酸溶液滴定NaOH和氨水混合溶液的电导率曲线 | |
| C. | 丙中曲线表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| D. | 丁中①、②曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
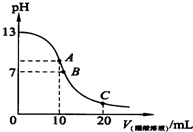 已知25℃时,0.10mol.L-1的CH3COOH的电离度为1.3%,pH=3.1.
已知25℃时,0.10mol.L-1的CH3COOH的电离度为1.3%,pH=3.1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请按要求回答下列问题.
请按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
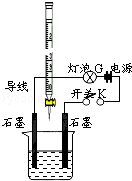 有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.
有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
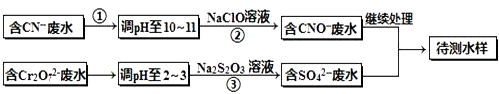
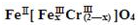 (铁氧磁体,罗马数字表示元素价态)的沉淀.
(铁氧磁体,罗马数字表示元素价态)的沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| B. | Ksp只与难溶电解质的性质和温度有关 | |
| C. | 其他条件不变,离子浓度改变时,Ksp不变 | |
| D. | 两种难溶电解质,Ksp小的,溶解度一定小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com