
| A. | 元素R位于周期表中第ⅦA族 | |
| B. | RO3-中的R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1 mol RO3-参与该反应,则转移的电子的物质的量为10mol |
分析 A、由反应方程式可知,R的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价;
B、RO3-中R为+5价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性;
C、若R为I或Br也可以发生如上反应;
D、反应中R元素化合价由+5价降低为0,据此计算.
解答 解:A、由反应方程式可知,R的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价,元素R应位于第ⅦA族,故A正确;
B、RO3-中R为+5价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性,故B错误;
C、若R为Cl,单质为气体,若R为I或Br也可以发生如上反应,碘为固体,溴为液体,故C错误;
D、反应中R元素化合价由+5价降低为0,若1molRO3-参与该反应,则转移的电子的物质的量为1mol×(5-0)=5mol,故D错误.
故选:A.
点评 本题考查学生氧化还原反应、元素性质与物质关系以及根据信息提取知识的能力等,难度中等,关键根据离子方程式判断R的最低负价为-1,最高正价为+7价.是对所学知识的综合运用与能力考查.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是用于衡量化学反应进行快慢的物理量 | |
| B. | 决定化学反应速率的主要因素是反应物本身的性质 | |
| C. | 可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零 | |
| D. | 增大反应物浓度或升高反应温度都能加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
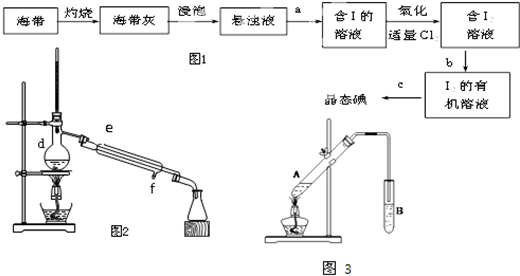
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯 | B. | 1,3-丁二烯 | C. | 丙炔 | D. | 2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与溴水(加成反应) | B. | 苯与液溴(取代反应) | ||
| C. | 乙醇与乙酸的酯化反应(取代反应) | D. | 乙醇与氧气(取代反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
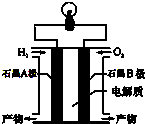 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 由于A、B两电极没有活动性差别,不能构成原电池 | |
| B. | A电极是负极,电极上发生氧化反应 | |
| C. | 产物为无污染的水,属于环境友好的绿色电池 | |
| D. | 外电路中电流由B电极通过导线流向A电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com