
【题目】糖尿病是一种常见病,发病率有逐年增加的趋势,且目前还没有根治的方法,下列叙述不正确的是( )
A.正常人的尿液中不含葡萄糖,只有糖尿病人才会出现糖尿
B.糖尿病的基因治疗是运用基因工程技术切除缺陷基因,从而达到治疗疾病的目的
C.凡是有甜味的食物都含有葡萄糖
D.医疗上用新制Cu(OH)2悬浊液来测定患者尿中葡萄糖的含量
科目:高中化学 来源: 题型:
【题目】某含铬(Cr2O72﹣)废水用硫酸亚铁铵废水用硫酸亚铁铵[FeSO4(NH4)2SO46H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀经干燥后得到n molFeOFeyCrxO3 . 不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(2﹣x)mol
B.处理废水中Cr2O72﹣的物质的量为nx/2mol
C.反应中发生转移的电子数为3nx NA
D.在FeOFeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含amol氯化铝的溶液中加入bmol氢氧化钾溶液,生成沉淀物质的量可能是( ) ①amol ②bmol ③ ![]() mol ④
mol ④ ![]() mol ⑤0mol ⑥(4a﹣b)mol.
mol ⑤0mol ⑥(4a﹣b)mol.
A.①②④⑤⑥
B.①③⑤
C.①②③⑤⑥
D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备气体和验证气体性质的装置图. 
(1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为 , 装置B盛放;装置C中试剂的作用是 .
(2)若利用如图装置实现碳和浓硫酸的反应,并进行如下验证: ①装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则D装置中品红溶液的作用是 , 证明气体中有CO2的现象是 .
②若证明SO2具有氧化性,同时证明碳酸的酸性比硅酸的强,B、C、D中分别装有Na2S溶液、足量酸性KMnO4溶液、品红溶液.
则:B中的现象 , F中应加入溶液,E中发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置(加持装置略去)能达到试验目的是( )
选项 | A | B | C | D |
装置 |
|
|
|
|
实验目的 | 比较非金属性:N>C>Si | 制备并收集乙酸乙酯 | 除去Ca(OH)2中的NH4Cl | 验证HCl的溶解性 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO3)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:
(1)HNO3的电离常数Ka的表达式为 .
(2)酸性条件下,K2Cr2O7能被NaNO2还原为Cr3+ , 该反应的离子方程式为 .
(3)25℃时,用0.100molL﹣1NaOH溶液滴定20.0mL某浓度的HNO3溶液,溶液的pH与NaOH溶液体积(V)的关系如图所示, 
已知:M点对应溶液中,c(OH﹣)=c(H+)+c(HNO2).则:
①原溶液中c(HNO2)为(保留三位有效数字).
②下列关于N点对应溶液的说法正确的是(填选项字母).
A.溶液只有NaNO2
B.水电离出来的c(H+)=1×10﹣7 molL﹣1
C.溶液中离子浓度:c(Na+)=c(NO3﹣)
D.溶液中:c(Na+)<c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用生锈的Fe粉和Cu粉的混合物制备CuSO45H2O和FeSO4(NH4)2SO46H2O的工艺流程如图1所示.
已知:①几种物质的溶解度(g/100gH2O)如表所示.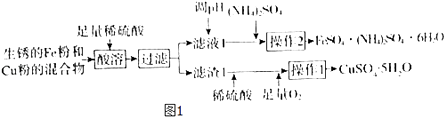
FeSO47H2O | (NH4)2SO4 | FeSO4(NH4)2SO46H2O | |
20℃ | 48 | 75 | 37 |
60℃ | 101 | 88 | 38 |
②溶液pH>4时,Fe2+容易被氧化.
请回答:
(1)过滤所用的主要玻璃仪器为 .
(2)溶液1中的主要溶质为(填化学式).
(3)进行操作2时,从溶液中析出晶体后,需趁热过滤,原因为 .
(4)FeSO4(NH4)2SO46H2O用适量稀硫酸洗涤,而不是用水洗涤的原因为 .
(5)称取2.50gCuSO45H2O样品,灼烧过程中样品质量随温度(T)变化的曲线如图2所示. 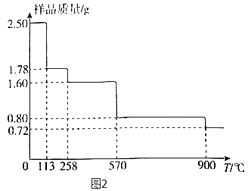
①120℃所的固体,继续加热至258℃时失水,所发生反应的化学方程式为 .
②900℃时剩余固体只有一种铜的氧化物,其化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H=0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05molL﹣1 . 则A的平均反应速率v(A)= . 该反应达到平衡时A的转化率为 , 如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为(填“变大”、 “变小”或“不变”)
(3)判断反应是否达到平衡的依据为(填字母代号).
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50mol D,此时v正v逆(填“大于”、“小于”或“等于”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com