
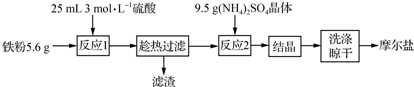
分析 Fe和稀硫酸反应生成硫酸亚铁,趁热过滤,然后想滤液中加入硫酸铵晶体,将溶液结晶、洗涤、晾干得到摩尔盐,
(1)温度越高,硫酸亚铁的溶解度越大;
(2)n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,n(H2SO4)=3mol×0.025L=0.075mol,二者反应方程式为Fe+H2SO4=H2↑+FeSO4,根据方程式知,Fe剩余,当硫酸浓度很稀时就不和Fe反应了;
(3)①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO42-离子沉淀完全(即该离子浓度须小于1×10-5 mol•L-1),则c(Ba2+)=$\frac{{K}_{sp}(BaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$,再根据Ba原子守恒计算c[(Ba(OH)2];
②摩尔盐和氢氧化钡反应生成硫酸钡、氨气、氢氧化亚铁,氢氧化亚铁不稳定,被氧化生成氢氧化铁红褐色沉淀,然后用足量稀盐酸溶解沉淀,最后得到的白色沉淀是BaSO4,n(BaSO4)=$\frac{2.796g}{233g/mol}$=0.012mol,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n 0.0500mol•L-1×0.020L
n(Fe2+)=0.001 mol×6=0.006mol
根据电荷守恒得n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.012mol,
n(H2O)=$\frac{\frac{4.704}{2}g-0.012mol×96g/mol-0.012mol×18g/mol-0.006mol/L×56g/mol}{18g/mol}$=0.036mol,
根据各微粒的物质的量之比确定化学式.
解答 解:Fe和稀硫酸反应生成硫酸亚铁,趁热过滤,然后想滤液中加入硫酸铵晶体,将溶液结晶、洗涤、晾干得到摩尔盐,
(1)温度越高,硫酸亚铁的溶解度越大,为降低硫酸亚铁的溶解度,需要趁热过滤,
故答案为:防止温度降低,硫酸亚铁晶体析出;
(2)n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,n(H2SO4)=3mol×0.025L=0.075mol,二者反应方程式为Fe+H2SO4=H2↑+FeSO4,根据方程式知,Fe剩余,当硫酸浓度很稀时就不和Fe反应了,所以理论上得到的硫酸亚铁物质的量小于0.075mol,故答案为:0.075;
(3)①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO42-离子沉淀完全(即该离子浓度须小于1×10-5 mol•L-1),则c(Ba2+)=$\frac{{K}_{sp}(BaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{1.1×1{0}^{-10}}{1{0}^{-5}}$mol/L=1.1×10-5mol•L-1,再根据Ba原子守恒得c[(Ba(OH)2]=c(Ba2+)=1.1×10-5mol•L-1,
故答案为:1.1×10-5;
②摩尔盐和氢氧化钡反应生成硫酸钡、氨气、氢氧化亚铁,氢氧化亚铁不稳定,被氧化生成氢氧化铁红褐色沉淀,然后用足量稀盐酸溶解沉淀,最后得到的白色沉淀是BaSO4,n(BaSO4)=$\frac{2.796g}{233g/mol}$=0.012mol,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n 0.0500mol•L-1×0.020L
n(Fe2+)=0.001 mol×6=0.006mol
根据电荷守恒得n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.012mol,
n(H2O)=$\frac{\frac{4.704}{2}g-0.012mol×96g/mol-0.012mol×18g/mol-0.006mol/L×56g/mol}{18g/mol}$=0.036mol,
n(SO42-):n(Fe2+):n(NH4+):n(H2O)=0 012 mol:0 006 mol:0 012mol:0036 mol=2:1:2:6,故莫尔盐的化学式为:(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O],
故答案为:(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O].
点评 本题考查物质制备实验方案设计,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 肯定是x+2 | B. | 肯定是x+2或x+8或x+32 | ||
| C. | 肯定是x+2或x+12或x+26 | D. | 肯定是x+2或x+10或x+26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
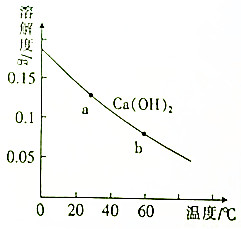 如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )
如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )| A. | a点和b点的Ksp:a<b | |
| B. | 向溶液a中加入CaO并恢复原温度时,溶液的pH不变 | |
| C. | b点时,Ca(OH)2在水中和在NaOH溶液中的溶解度:s(H2O)>s(NaOH) | |
| D. | 溶解速率:b点>a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应、稀醋酸与稀NaOH溶液反应所测得的中和热都为△H=-57.3kJ/mol | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+1.9kJ/mol,可知金刚石比石墨稳定 | |
| C. | 在用标准盐酸滴定未知浓度氢氧化钠溶液的实验中,若用待测液润洗锥形瓶,则测定结果偏低(其他操作正确) | |
| D. | 向存在着FeCl3 (黄色)+3KSCN?Fe(SCN)3(血红色)+3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定前,未用NaOH溶液对锥形瓶进行润洗 | |
| B. | 滴定过程中,有少量盐酸滴在锥形瓶外 | |
| C. | 盛装盐酸前,未对酸式滴定管进行润洗 | |
| D. | 滴定终点时,对酸式滴定管俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于周期表中同一周期的元素,原子具有相同的电子层数 | |
| B. | 凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数 | |
| C. | 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8 | |
| D. | 凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com