
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答:
(1)“O”点导电能力为0的理由是 。
(2)A、B、C三点溶液c(H+)由小到大的顺序为 。
(3)若使C点溶液中c(CH3COO-)增大的同时溶液的c(H+)减小,可采取的措施是:
① ;② ;③ 。
(4)经实验测得C点处:c(CH3COOH)="0.1" mol·L-1,c(CH3COO-)="0.01" mol·L-1,则该条件下CH3COOH的电离常数Ka= 。
科目:高中化学 来源: 题型:填空题
(12分)镧是重要的稀土元素,应用非常广泛,如应用于压电材料、催化剂等领域。
已知:①镧是较活泼金属,在空气中易被氧化;②氢氧化镧是难溶于水的弱碱;
③
| 金属 | 熔点(℃) | 沸点(℃) |
| 钙 | 841 | 1487 |
| 镧 | 920 | 3470 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为 。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示) 。
(3)某温度时,0.01mol/L的NaOH溶液PH=11,则该温度 25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10 mol/L,则该溶液的pH为 。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 (填“酸性”、“碱性”或“中性”),溶液中c(Na+) c(CH3COO-)(填“>”、“<”或“=”)。
(5)若物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 (填“酸性”、“碱性”或“中性”),醋酸体积 氢氧化钠溶液体积(填“>”、“<”或“=”)。
(6)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq)在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号),此时溶液②中Cl-物质的量浓度为 。
Ag+(aq)+Cl-(aq)在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号),此时溶液②中Cl-物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在平衡:H2O H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母)。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母)。
| A.向水中加入NaHSO4 |
| B.向水中加入Cu(NO3)2 |
| C.加热水至100 ℃[其中c(H+)=1×10-6 mol·L-1] |
| D.在水中加入(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42—离子物质的量浓度的对数,回答下列问题。
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
(4)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
| c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有0.175mol/L醋酸钠溶液500mL(已知醋酸的电离常数Ka=1.75x10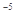 )
)
(1)写出醋酸钠水解反应的化学方程式_____________________。
(2)下列图像能说明醋酸钠的水解反应达到平衡的是_____________________。
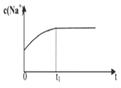 | 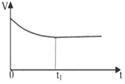 | 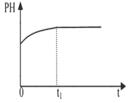 |  |
| A.溶液中c (Na+)与反应时间t的关系 | B.CH3COO-的水解速率与反应时间t的关系 | C.溶液的PH与反应时间t的关系 | D.KW与反应时间t的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: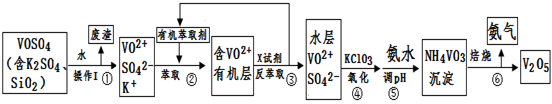
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl溶液与0.04 mol·L-1的NaHA溶液等体积混合
④0.02 mol·L-1的NaOH溶液与0.02 mol·L-1的NaHA溶液等体积混合
下列关于上述四种溶液的说法不正确的是 ( )
A.溶液②中存在水解平衡:HA-+H2O H2A+OH-
H2A+OH-
B.溶液③中有:c(HA-)+c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c(HA-)大小:③>①>②>④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com