
【题目】将ag氧化铁和硫化亚铁组成的混合物溶解在足量的稀盐酸中,结果得到bg沉淀,则原混合物中硫化亚铁的质量可能为( )
A.5bgB.(a5b) gC.(a 11b/4)gD.11b/4g
【答案】BD
【解析】
生成的沉淀为S单质,当硫化亚铁过量时,氧化铁完全反应,根据电子守恒计算出氧化铁的物质的量,再根据总质量计算出硫化亚铁的质量;当氧化铁过量时,硫化亚铁完全反应,根据S元素质量守恒可以计算出硫化亚铁的物质的量及质量。
生成的bg沉淀为S单质,其物质的量为:n(S)=![]() mol;
mol;
当硫化亚铁过量时,氧化铁完全反应,根据电子守恒可知氧化铁的物质的量,n(Fe2O3)= mol,混合物中氧化铁的质量为:160g/mol×
mol,混合物中氧化铁的质量为:160g/mol×![]() mol=5bg,硫化亚铁的质量为:ag5bg=(a5b)g;
mol=5bg,硫化亚铁的质量为:ag5bg=(a5b)g;
当Fe2O3过量时,FeS完全反应,根据S元素质量守恒可知FeS的物质的量![]() mol,FeS的质量为:m(FeS)=88g/mol×
mol,FeS的质量为:m(FeS)=88g/mol×![]() mol=
mol=![]() bg;
bg;
答案选BD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:①H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)
A. Q1+Q2+Q3B. 1.5Q1-0.5Q2+0.5Q3
C. 0.5Q1-1.5Q2+0.5Q3D. 0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.物质A的转化率提高了B.平衡向逆反应方向移动了
C.物质B的质量分数减少了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾晶体化学式为:KxFey(CN)znH2O,俗称黄血盐,常用作食品抗结剂。一种用NaCN(N显-3价)废液制取黄血盐的主要工艺流程:
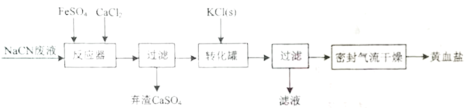
(1)实验室用绿矾固体配制FeSO4溶液时,应先________,再用蒸馏水稀释。
(2)“转化罐”中生成黄血盐晶体的反应类型为________。
(3)采用密封气流干燥取代在通风橱内干燥的原因是________。
(4)黄血盐的化学式可通过下列实验测定:
①准确称取4.220g样品加入水中充分溶解,将所得溶液转移至容量瓶配制成100.00mL溶液A。
②量取25.00mL溶液A,用2.000molL-1KMnO4溶液滴定,达到滴定终点时,共消耗KMnO4溶液15.25mL。反应如下(未配平):![]() ③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
通过计算确定样品的化学式(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱去冶金工业排放烟气中![]() 的方法有多种。
的方法有多种。
(1)利用本生(Bunsen)热化学循环吸收![]() 工艺由下列三个反应组成:
工艺由下列三个反应组成:
![]()
![]()
![]()
![]()
![]()
![]()
则![]()
![]() ________
________![]() 。
。
(2)氧化锌吸收法:配制![]() 悬浊液,在吸收塔中封闭循环脱硫。测得pH、吸收效率
悬浊液,在吸收塔中封闭循环脱硫。测得pH、吸收效率![]() 随时间t的变化如图甲;溶液中部分微粒与pH的关系如图乙所示。
随时间t的变化如图甲;溶液中部分微粒与pH的关系如图乙所示。
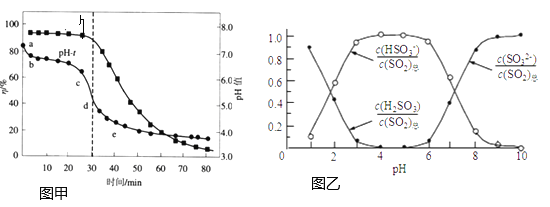
①为提高![]() 的吸收效率
的吸收效率![]() ,可采取的措施有:增大悬浊液中
,可采取的措施有:增大悬浊液中![]() 的量、________。
的量、________。
②图甲中的![]() 曲线ab段发生的主要化学方程式为________。
曲线ab段发生的主要化学方程式为________。
③![]() 时,溶液
时,溶液 ________。
________。
(3)如图丙所示,利用惰性电极电解含![]() 的烟气回收S及
的烟气回收S及![]() ,以实现废物再利用。
,以实现废物再利用。

①阴极的电极反应式为________。
②每处理含![]() 的烟气,理论上回收S、
的烟气,理论上回收S、![]() 的物质的量分别为________、________。
的物质的量分别为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
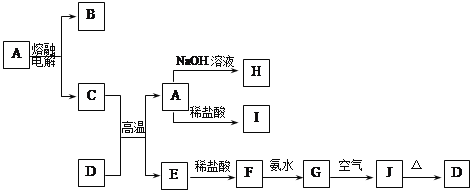
请回答下列问题:
(1)A的化学式为_______,在水中的溶解性_____(选填“易溶”、“可溶”、“难溶”)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是____________________。
G→J的化学方程式为___________________________________________。
反应的现象是______________________________________________。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
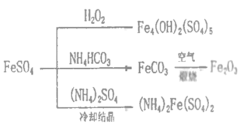
A.FeCO3转化为铁红的化学方程式:4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
B.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小
C.制备Fe4(OH)2(SO4)5、Fe2O3、(NH4)2Fe(SO4)2的过程都发生了氧化还原反应
D.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2 + 6NaOH ![]() 5NaCl + NaClO3 + 3H2O,以下叙述正确的是( )
5NaCl + NaClO3 + 3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子与被还原的Cl原子的个数比为1∶5
C.氧化产物与还原产物的物质的量的比为5∶1
D.每生成1mol的NaClO3转移6mol的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】飞秒(1fs=10-15s)化学广泛应用于化学研究。大多双分子反应难于确定反应历程,Zewail通过研究HI与CO2反应巧妙的解决了这个问题,其反应过程中的片断:![]() (1ps=1000fs)。下列说法不正确的是
(1ps=1000fs)。下列说法不正确的是
A.反应过程中CO2未全部断键而HI全部断键
B.HOCO是HI与CO2双分子反应的过渡态产物
C.观察到HOCO解离需用1ps,说明HI与CO2反应极快
D.该反应的起点是HI的解离,终点是OH自由基与I自由基的结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com