
【题目】现已知O3分子为V字形结构,O3在水中的溶解度和O2比较
A.O3在水中的溶解度和O2一样 B.O3在水中的溶解度比O2小
C.O3在水中的溶解度比O2要大 D.没办法比较
科目:高中化学 来源: 题型:
【题目】I.经测定乙醇的化学式是C2H6O,由于有机物普遍存在同分异构现象,推测乙醇的结构可能是下列两种之一。

为测定其结构,应利用物质的特殊性进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁4位同学利用如下图的装置进行实验,确定乙醇的结构。

(1)同学甲得到一组实验数据如表:
乙醇的物质的量/mol | 氢气的体积/L |
0.10 | 1.12(标准状况) |
根据以上数据推断乙醇的结构为______(用Ⅰ、Ⅱ表示),理由为____________;
(2)同学乙分别准确称量4.60 g乙醇进行多次实验,结果发现以排在量筒内水的体积作为生成的H2体积,换算成标准状况后都小于1.12 L。如果忽略量筒本身及乙同学读数造成的误差,乙同学认为可能是由于样品中含有少量水造成的,你认为正确吗?______(填“正确”或“不正确”)。请说明理由__________________________________________________________________。
(3)同学丙认为实验成功的关键有:①装置气密性要良好;②实验开始前准确确定乙醇的量;③钠足量;④广口瓶内水必须充满;⑤氢气体积的测算方法正确、数据准确。其中,正确的有_________________(填序号)。
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么还需要知道的数据是________。
(5)实验后,4名同学从乙醇的可能结构分析入手,对乙醇和钠的量的关系进行了讨论,如果乙醇的物质的量为n mol,那么对钠的物质的量的取值要求,必须是____________。
II.已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
(1)A的结构简式为______________________,在农业上可以用于________________。
(2)E的结构简式为___________________;B、D分子与金属钠反应的化学方程式为____________________________、____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是( )
A.Na+、K+、OH﹣、Cl﹣
B.Na+、Cu2+、SO42﹣、NO3﹣
C.Mg2+、Na+、SO42﹣、Cl﹣
D.K+、Na+、NO3﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按照单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( )
A.水银、干冰、硫酸、烧碱、纯碱
B.碘酒、冰、硝酸、苛性钠、胆矾
C.氢气、二氧化硫、盐酸、纯碱、硫酸铜
D.铜、氧化铜、醋酸、熟石灰、石灰石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
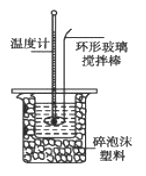
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):_____________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:______。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是________。
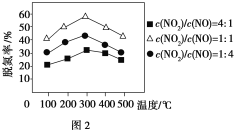
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:

①由图1可知SCR技术中的氧化剂为________。
②用Fe作催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)=________。
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO![]() ,SO
,SO![]() 可以被海水中的溶解氧氧化为SO
可以被海水中的溶解氧氧化为SO![]() 。海水的pH会________(填“升高”“不变”或“降低”)。
。海水的pH会________(填“升高”“不变”或“降低”)。
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是_____________________。
(4)碲(Te)为第ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是___________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol·L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示。下列说法不正确的是( )

A. 由图中数据可计算得到常温下亚硫酸溶液的Ka2
B. 在0.1mol·L-1H2SO3溶液中,存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)·c(SO32-)+Kw
C. 向pH为7的溶液中滴入少量稀盐酸造成的溶液pH变化小于向pH为4.0的溶液中滴入相同量稀盐酸造成的溶液pH变化
D. 在pH=2.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com