
如图是元素周期表的一部分,下列关系正确的是( )
| S | Cl |
| Se | Br |
A.还原性:Se2->S2->Cl-
B.热稳定性:HCl>H2Se>HBr
C.原子半径:Se>Cl>S
D.酸性:HBrO4>HClO4>H2SO4
科目:高中化学 来源: 题型:
.一定量的CuS和Cu2S的混合物投入足量的 HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A.9.0L B.13.5L C.15.7L D.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
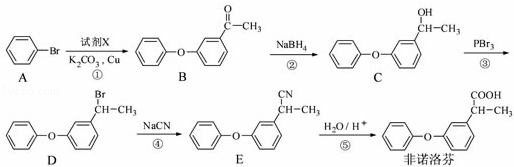
请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称).
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 .
(3)在上述五步反应中,属于取代反应的是 (填序号).
(4)B的一种同分异构体满足下列条件:
Ⅰ、能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应.
Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环.
写出该同分异构体的结构简式: .
(5)根据已有知识并结合相关信息,写出以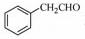 为原料制备
为原料制备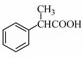 的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
CH3CH2Br CH3CH2OH
CH3CH2OH CH3COOCH2CH3.
CH3COOCH2CH3.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.摩尔质量就等于物质的式量
B.摩尔质量就是物质相对分子质量的6.02×1023倍
C.SO 的摩尔质量是96 g
的摩尔质量是96 g
D.CO和N2的摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
现有原子序数依次相差1,且由小到大排列的A、B、C、D、E五种短周期元素。下列有关这五种元素的叙述正确的是( )
①若A的最高价氧化物对应的水化物是强碱,则E的最高价氧化物对应的水化物是强酸
②若A的单质既能与强酸又能与强碱反应且都放出氢气,则这五种元素在同一周期
③若A的阳离子比E的阴离子少8个电子,则D一定是非金属元素
④若D的最高价氧化物对应的水化物是强酸,则E的单质在常温下为气态
⑤这五种原子的原子半径关系一定为:A>B>C>D>E
A.②③④ B.①②③
C.③④⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变 化如表:
化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。
(2)如图所示,表示NO2变化曲线的是________。用O2表示从0 s~2 s内该反应的平均速率v=________________。
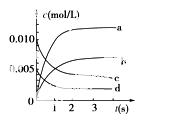
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c .v逆(NO)=2v正(O2) d.容器内密度保持不变
.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中,反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H<0达到平衡后,改变某一条件,下列说法正确的是
CH3OH(g)+H2O(g) △H<0达到平衡后,改变某一条件,下列说法正确的是
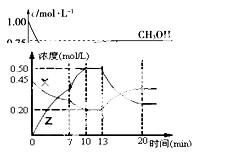
A.升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动
B.升高温度,可提高CO2转化率
C.增加H2的浓度,可提高CO2转化率
D.改用高效催化剂,可增大反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com