
【题目】铁及其化合物在生产、生活中存在广泛用途。
(1)基态铁原子电子排布式为___,自然界中存在的54Fe和56Fe,它们互称为__。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是___。通常证明某溶液中含Fe3+的实验步骤是__。
(3)SO2有强还原性,写出其与FeCl3溶液反应的离子方程式___。若有0.4molFeCl3发生反应,则需要标准状况下的SO2__升。
(4)发黄的深井水通常含Fe3+,若向水中加入Na2CO3溶液,则产生红褐色沉淀和无色无味的气体。写出相应的离子方程式___。
【答案】1s22s22p63s23p63d64s2 同位素 钝化 取样滴加KSCN溶液,出现血红色,证明含Fe3+ SO2+2Fe3++2H2O=2Fe2++SO![]() +4H+ 4.48 2Fe3++3CO
+4H+ 4.48 2Fe3++3CO![]() +3H2O=2Fe(OH)3↓+3CO2↑
+3H2O=2Fe(OH)3↓+3CO2↑
【解析】
(1)铁元素为26号元素,所以基态铁原子的电子排布式为1s22s22p63s23p63d64s2;54Fe和56Fe为铁元素的不同核素,互为同位素;
(2)铁单质在冷的浓硫酸中发生钝化,形成致密氧化膜,阻止了铁与铜离子的反应;Fe3+可以和KSCN溶液反应显红色,检验Fe3+可取样滴加KSCN溶液,出现血红色,证明含Fe3+;
(3)Fe3+具有较强氧化性,SO2具有强还原性,所以铁离子可以将SO2氧化成SO![]() ,根据电子守恒和元素守恒可得离子方程式为SO2+2Fe3++2H2O=2Fe2++SO
,根据电子守恒和元素守恒可得离子方程式为SO2+2Fe3++2H2O=2Fe2++SO![]() +4H+;根据离子方程式可知当0.4mol FeCl3发生反应时需要0.2molSO2,标况下体积为0.2mol×22.4L/mol=4.48L;
+4H+;根据离子方程式可知当0.4mol FeCl3发生反应时需要0.2molSO2,标况下体积为0.2mol×22.4L/mol=4.48L;
(4) Fe3+水解使溶液显酸性,CO![]() 水解使溶液显碱性,产生红褐色沉淀和无色无味的气体说明Fe3+和CO
水解使溶液显碱性,产生红褐色沉淀和无色无味的气体说明Fe3+和CO![]() 发生双水解,离子方程式为2Fe3++3CO
发生双水解,离子方程式为2Fe3++3CO![]() +3H2O=2Fe(OH)3↓+3CO2↑。
+3H2O=2Fe(OH)3↓+3CO2↑。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图Ⅱ表示常温下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D. 图Ⅳ表示反应4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOHmolL-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为______________;
(2)盛装标准盐酸的仪器名称为______________;
(3)滴定至终点的颜色变化为______________;
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为______________;
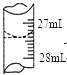
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为______________; (保留四位有效数字)
实验序号 | 待测NaOH溶液的体积/mL | 0.1000molL-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
(6)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的容器中,用纯净的CaCO3与100mL稀盐酸反应制取CO2,反应生成CO2的体积随时间的变化关系如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
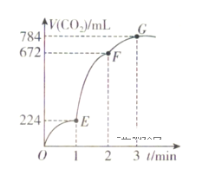
A.OE段表示的平均反应速率最快
B.G点收集到的CO2的量最多
C.EF段,用盐酸表示该反应的平均反应速率为0.04mol·L-1·min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )

A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )

A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀,然后沉淀又溶解
C.实验仪器D可以起到防止溶液倒吸的作用
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 molL-1s-1 B. υ(C)=0.010 molL-1s-1
C. υ(B)=0.6 molL-1min-1 D. υ(A)=0.2molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。某课外小组模拟其原理选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明潮湿的CO2可与过氧化钠反应生成O2。可供选择的药品有:石灰石、盐酸、饱和NaHCO3溶液、NaOH溶液、Na2O2固体
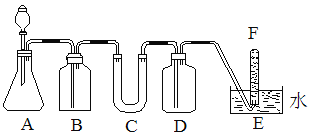
(1)如何检查该套装置的气密性?____________ 。
(2)A是制取CO2的装置,写出A中发生反应的化学方程式______________。
(3)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | ________ | 吸收挥发出来的HCl |
C | ________ | |
D | ________ | ________ |
(4)写出过氧化钠与二氧化碳反应的化学方程式:_______________。
(5)试管F中收集满气体后,要用拇指堵住试管口,移出水面,接下来的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素(以I形式存在)。实验室中提取碘的流程如下:

(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78 ℃) B.四氯化碳(沸点77 ℃)
C.甘油(沸点290 ℃) D.苯(沸点80 ℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量________(填序号)溶液,反应的离子方程式___________________。
A.KIO3 B.HClO C.KI D.Br2
(4)利用碘的有机溶液得到单质I2的方法是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com