
【题目】分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、NOx、SO2等,其主要来源为燃煤和机动车尾气排放等。
(1) 某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:
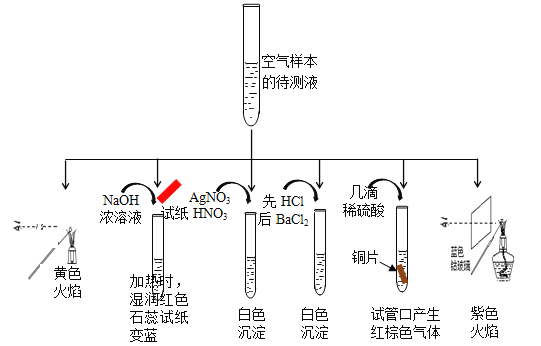
①该实验能确认存在的阳离子是 。
②该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③根据该实验能否确定样本中含有SO32-, (填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是 。
(2)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法不正确的是 (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(3)科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
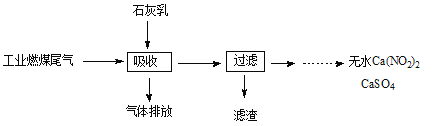
①CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为 。
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式 。
【答案】(1)①Na+、NH4+、K+
②3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O(1分)2NO+O2=2NO2(1分)
③否;酸性高锰酸钾溶液(各1分,共2分)
(2)bc(2分,漏选1分\错选不得分)
(3)①2SO2+O2+2Ca(OH)2=2CaSO4+2H2O(2分)
②NO+NO2+Ca(OH)2=Ca(NO2)2+H2O(2分)
【解析】
试题分析:(1)①物质焰色反应为黄色,所以含有钠离子,和强碱共热反应产生氨气,能使石蕊试纸变蓝,证明含有铵根离子,加入硝酸酸化的硝酸银会产生白色沉淀,证明含有氯离子或是亚硫酸根离子中的一种,先加盐酸再加入氯化钡,产生白色沉淀,证明含有硫酸根离子,溶液中加入几滴硫酸,再加入金属铜,可以产生红棕色的气体,证明原溶液含有硝酸根离子,透过钴玻璃观察焰色反应呈现紫色,证明含钾离子,一定含有的钾离子是Na+、NH4+、K+;
②溶液中加入几滴硫酸,再加入金属铜,可以产生红棕色的气体,证明原溶液含有硝酸根离子,金属铜可以和硝酸反应产生硝酸铜、一氧化氮和水,一氧化氮遇到空气迅速变为红棕色,即:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、2NO+O2=2NO2;
③该实验不能确定样本中含有SO32-,加入硝酸酸化的硝酸银会产生白色沉淀,证明可能含有氯离子或是亚硫酸根离子中的一种,亚硫酸根离子可以和硝酸之间反应得到硫酸根离子,亚硫酸根离子可以使高锰酸钾褪色,但是硫酸根离子不能,可以采用高锰酸钾检验亚硫酸根离子的存在;
(2)a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程,a正确;b.PM2.5颗粒小,但仍然对人体有害,b错误;c.直径介于1~2.5μm的颗粒物分散到空气中不能形成胶体,应该是1nm~100nm,c错误;d.推广使用电动汽车,可以减少PM2.5的污染,d正确,答案选bc;
(3)①尾气中SO2与石灰乳反应生成CaSO4,说明还有氧气参与,反应化学方程式为2SO2 + O2 +2Ca(OH)2=2CaSO4 + 2H2O。②NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式为NO + NO2 + Ca(OH)2=Ca(NO2)2 + H2O。


科目:高中化学 来源: 题型:
【题目】下列影响化学反应速率的因素中,是通过改变活化分子百分数来实现的是
①改变气体物质的浓度 ②改变气体的压强
③加入催化剂 ④改变气体的温度
A.只有①② B.只有③④ C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1;2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b
B.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
C.由C(石墨)=C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
D.在100 kPa时,1 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往2L密闭容器中充入NO2,在三种不同条件下发生反应:![]()
实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。

下列说法正确的是
A. 实验2比实验1的反应容器体积减小
B. 实验2比实验l使用了效率更高的催化剂
C. 实验2和实验3可判断该反应是放热反应
D. 实验1比实验3的平衡常数大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之问能发生如下反应,其中乙是黄绿色气体(图中有些反应的产物和反应的条件没有全部标出)。
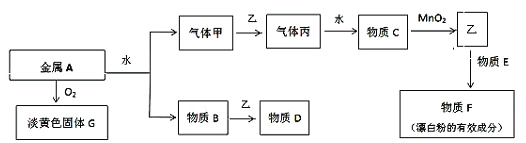
请根据以上信息回答下列问题:
(1)写出下列物质的名称:丙- ;
(2)写出下列物质的化学式:F________________;
(3)气体乙是一种重要的化工原料,在工农业牛产、牛活中有着重要的应用。请你根据所学
知识回答下列问题:
把气体乙通入紫色石蕊溶液中,可以观察到的现象是:__________,请你解释其中的原因 。
某化学兴趣小组计划用气体乙和物质B制取简易消毒液D。其反应原理为:(用化学方程式
表示)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质电离的叙述中正确的是( )
A.CaCO3在水中溶解度很小,其导电能力很弱,所以CaCO3是弱电解质
B.CaCO3在水中溶解度很小,但溶解的CaCO3全部电离,所以CaCO3是强电解质
C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质
D.水难电离,纯水几乎不导电,水是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
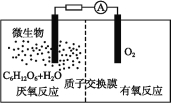
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl-、CO![]() 、OH-3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次沉淀出来,下列实验操作顺序正确的是( )
、OH-3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次沉淀出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com