
| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,溶液变红色 | |
| C. | Fe2+和Fe3+物质的量之比为5:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |
分析 铁粉的物质的量为$\frac{11.2g}{56g/mol}$=0.2mol,氯化铁的物质的量为2mol/L×0.25L=0.5mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.2mol铁粉完全反应需要0.4mol氯化铁,氯化铁有剩余,结合方程式计算解答.
解答 解:铁粉的物质的量为$\frac{11.2g}{56g/mol}$=0.2mol,氯化铁的物质的量为2mol/L×0.25L=0.5mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,假设0.2mol铁粉完全反应,则消耗氯化铁为0.2mol×2=0.4mol<0.5mol,氯化铁有剩余.
A.铁完全反应,氯化铁有剩余,Cl-浓度基本不变,故A错误;
B.氯化铁有剩余,往溶液中滴入无色KSCN溶液,溶液显红色,故B正确;
C.0.2molFe反应生成Fe2+为0.6mol,剩余Fe3+为0.5mol-0.4mol=0.1mol,其物质的量之比为6:1,故C错误;
D.氧化产物与还原产物均为氯化亚铁,Fe被氧化,氯化铁被还原,则氧化产物与还原产物的物质的量之比为1:2,故D错误,
故选B.
点评 本题考查化学方程式有关计算,难度不大,关键是根据化学方程式的进行过量计算.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有金属元素 | |
| B. | 金属元素不可能存在于阴离子中 | |
| C. | 含有非极性键的化合物不一定是共价化合物 | |
| D. | 由两种元素构成的共价化合物分子中的化学键都是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C23H48、C25H52、C27H56互为同系物 | |
| B. | 1molC23H48含共价键70mol | |
| C. | C23H48、C25H52、C27H56的碳含量依次减小 | |
| D. | C23H48、C25H52、C27H56均能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、O2分别为0.8 mol/L、0.4mol/L | B. | SO2为0.5mol/L | ||
| C. | SO2、SO3均为0.3mol/L | D. | SO2为0.5mol/L,SO3为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氟化氮的电子式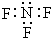 | B. | 水合氢离子电子式: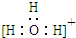 | ||
| C. | 氟离子的结构示意图: | D. | 中子数为18的硫原子${\;}_{16}^{34}$S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0表示放热,△H<0表示吸热 | |
| C. | 0.5mol H2SO4与0.5molBa(OH)2反应生成1mol水时放出的热叫做中和热 | |
| D. | 1molH2与0.5molO2燃烧放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸干碳酸钾溶液得到的固体物质为KOH | |
| B. | 铁表面镀铜时,铜与电源的负极相连,而铁与电源的正极相连 | |
| C. | 工业合成氨反应温度选择700 K左右,可使催化剂活性最强并提高原料利用率 | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=2×283.0kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com