
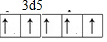
 .
.分析 (1)由不同非金属元素形成的化学键为极性键,由同种非金属元素形成的化学键为非极性键,只含非极性键的分子为非极性分子;若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子,极性分子中正负电荷的中心不重合,具有一定的极性,以此来解答;
(2)①根据等电子体中原子数相同、价电子数相同分析;
②根据中心原子形成的δ键和孤电子对数判断杂化类型;
③据CO2的结构式O=C=O判断;
(3)①Mn的原子序数为25,根据能量最低原理可写出Mn的基态原子的电子排布式,进而可确定Mn2+基态的电子排布式;
②计算C原子价层电子对数、孤电子对数,进而确定其空间构型;
解答 解:(1)a.CH2O是极性键形成的极性分子,故错误;b.CO2是极性键形成的非极性分子,故正确;c.CO是极性键形成的极性分子,故错误;d.H2O是极性键形成的极性分子,故错误;e.Na2CO3是离子晶体构成微粒不是分子,故错误;故选B;
(2)①CO含有2个原子14个电子,所以CO互为等电子体的一种分子和一种离子的化学式为:N2、CN-(或O22+、C22-、NO+),
故答案为:O22+、C22-;
②HCHO中碳原子含有3个σ键,不含孤电子对,采用sp2 杂化,
故答案为:sp2;
③CO2的结构式为O=C=O,分子中C形成2个δ键,则1molCO2中含有的σ键数目为2mol或2×6.02×1023或2NA,
故答案为:2mol或2×6.02×1023或2NA;
(3)①Mn的原子序数为25,基态原子的电子排布式为,1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),所以外围电子排布图为: 故答案为:
故答案为: ;
;
②CO32-中C原子价层电子对数为$\frac{4+2}{2}$=3、没有孤对电子,其空间构型为平面三角形,
故答案为:CO32-中C原子价层电子对数为$\frac{4+2}{2}$=3、则碳是sp2杂化,没有孤对电子,其空间构型为平面三角形.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、空间构型、等电子体等,注意对基础知识的理解掌握.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基-2-乙基己烷 | B. | CH3CH2CH2Cl氯丙烷 | ||
| C. |  属于芳香醇 属于芳香醇 | D. |  属于芳香化合物 属于芳香化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
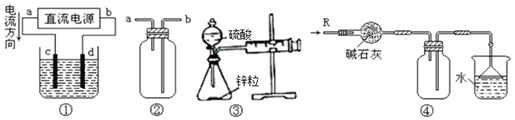
| A. | 装置①中,d为阳极、c为阴极 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体 | |
| C. | 装置③结合秒表可测量锌与硫酸的反应速率 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物一定都是酸性氧化物 | |
| B. | 碱性氧化物一定都是金属氧化物 | |
| C. | 既能与酸反应又能与碱反应的物质一定具有两性 | |
| D. | 氧化还原反应一定都是离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的原子失电子能力比镁弱 | B. | 砹(At)的氢化物不稳定 | ||
| C. | 硒的原子半径比硫小 | D. | Sr(OH)2 比Ca(OH)2 碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时Kw=1.0×10-14,将稀硫酸加热至90℃(忽略溶液体积变化)其pH不变 | |
| B. | pH与体积都相同的醋酸和硝酸溶液分别用0.1mol•L-1氢氧化钠溶液恰好中和,所需的氢氧化钠溶液体积前者一定大于后者 | |
| C. | 0.2 mol•L-1CH3COONa溶液和0.1mol•L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-) | |
| D. | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量KI溶液,若开始有白色沉淀生成,后逐渐变为黄色沉淀,即说明Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
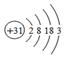 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH)3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Sr(OH)2溶解于水 | B. | SrSO4难溶于水 | ||
| C. | BaSO4不溶于水 | D. | Ba(OH)2比Ca(OH)2更难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
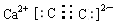 ,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com