
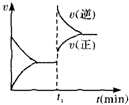
| A. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | B. | 2SO2(g)+O2(g)?2SO3(g)△H<0 | ||
| C. | H2(g)+I2(g)?2HI(g)△H>0 | D. | C(s)+H2O(g)?CO(g)+H2(g)△H>0 |
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
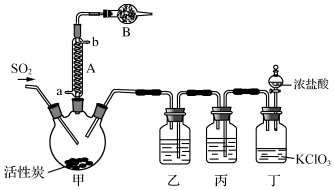
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取5.85gNaCl | |
| B. | 用广泛pH试纸测得橙汁pH为3.50 | |
| C. | 用酸式滴定管量取25.00 mL高锰酸钾溶液 | |
| D. | 用酸性高锰酸钾溶液检验FeCl3中是否含有FeC12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.012kg12C所含的碳原子数就是阿伏伽德罗常数 | |
| B. | 等质量的O2和O3中所含氧原子的物质的量相同 | |
| C. | 等物质的量的分子所含原子数目一定相等 | |
| D. | 标准状况下,1molH2的体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com