
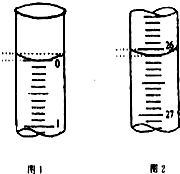
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
分析 (1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时溶液颜色由黄色突变为橙色,且半分钟内不复原;
(2)根据滴定管的结构和精确度以及测量的原理;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据 HCl+NaOH=NaCl+H2O求出C(NaOH);
解答 解:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时溶液颜色由黄色突变为橙色,且半分钟内不复原;
故答案为:锥形瓶中溶液颜色变化;半分钟内不复原;
(2)起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL,
故答案为:26.10;
(3)A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知c(待测)偏大,故A错误;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,造成V(标准)不变,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知c(待测)不变,故B错误;
C、读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知c(待测)偏小,故C正确;
D、酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知c(待测)偏大,故D错误;
故选C;
(4)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=26.10mL,
HCl+NaOH=NaCl+H2O
0.0261L×0.1000mol/L 0.025L×C(NaOH)
则C(NaOH)=$\frac{O.0261L×0.1000mol/L}{0.025L}$=0.1044mol/L;
故答案为:0.1044mol/L;
点评 本题主要考查了中和滴定操作、误差分析以及计算,难度不大,根据实验原理即可完成.


科目:高中化学 来源: 题型:选择题
| A. | 四种溶液中的KW相同,由水电离出的c(H+):①=②=③=④ | |
| B. | 取体积相同的溶液①、②、③分别与足量铝粉反应,生成H2的量:①最少 | |
| C. | 将等体积的四种溶液分别稀释100倍,所得溶液的pH:③>④>②>① | |
| D. | 常温下,将②和③等体积混合:c(CH3COO-)-c(Na+)=c(H+)-c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
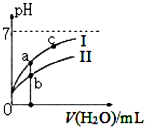 己知:下表为25℃时某些弱酸的电离平衡常数.
己知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 图中c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HCIO) | |
| B. | pH相同的四种溶液浓度关系:c(CH3COONa>c(NaHC03>c(NaClO>c(Na2C03) | |
| C. | 图中a点酸的总浓度小于b点酸的总浓度 | |
| D. | 浓度均为0.l mol/L的CH3COONa和NaCIO的混合溶液中:c(OH-)=0.l mol/L-c(ClO-)+c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水中铵根离子和氢氧化钠溶液中钠离子浓度相等 | |
| B. | 温度下降10℃,两溶液的pH均不变 | |
| C. | 氨水和氢氧化钠溶液的浓度相等 | |
| D. | 分别与等浓度的盐酸反应,氨水消耗盐酸的体积与氢氧化钠消耗盐酸的体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
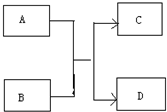 运用有关知识,回答下列问题.
运用有关知识,回答下列问题.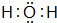 ,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.
,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com