
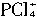 +
+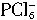 。
。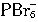 +Br-。
+Br-。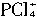 的可能,因为
的可能,因为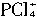 无论如何不会有两种不同的键长(不管它是正四面体形还是平面四边形),所以两种离子可能是
无论如何不会有两种不同的键长(不管它是正四面体形还是平面四边形),所以两种离子可能是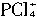 和
和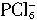 。
。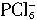 相似的
相似的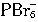 是不是也能形成。如果同学们脑海中浮现出溴离子和氯离子相对大小的图像,就会想像到6个溴离子包在半径很小的P5+外面可能实在太挤了,挤不下了,而较小的氯离子则是有可能的。因而,
是不是也能形成。如果同学们脑海中浮现出溴离子和氯离子相对大小的图像,就会想像到6个溴离子包在半径很小的P5+外面可能实在太挤了,挤不下了,而较小的氯离子则是有可能的。因而,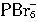 是不能形成的,所以PBr5中的阴离子只能是溴离子。学化学需要有很好的想像力,而想像是创新所不可缺少的思维形式。
是不能形成的,所以PBr5中的阴离子只能是溴离子。学化学需要有很好的想像力,而想像是创新所不可缺少的思维形式。 

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
| A、氧化钠是一种白色固体 | B、过氧化钠与水反应放出氢气 | C、烧碱和纯碱进行焰色反应,火焰都呈黄色 | D、往碳酸氢钠溶液中加入氢氧化钠溶液可以转化为碳酸钠 |
查看答案和解析>>
科目:高中化学 来源:三点一测丛书 高中化学 必修2 (江苏版课标本) 江苏版课标本 题型:043
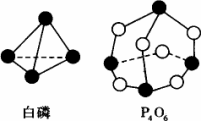
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放出(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 O-O:498计算反应P4(白磷)+3O2→P4O6的反应热为________.
PCl5也是一种白色固体,加热到160℃不经过液态阶段就变为蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3 g·L-1,继续加热到250℃时测得压力为计算值的两倍.PCl5在加压下于148℃液化,形成一种能导电的液体,测得P-Cl的键长为198 pm和206 pm两种.根据以上条件回答下列问题:
(1)PCl5固体是一种什么类型的晶体?180℃下PCl5蒸气中存在什么分子?为什么?
(2)250℃下PCl5蒸气中存在什么分子?为什么?
(3)PCl5熔体为什么导电?用最简洁的形式作出解释?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在
(2)在
(3)PCl5是共价型分子化合物,熔融时为什么能导电?解释有两种P—Cl键键长的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3g/L, 极性为零,P—Cl键长为204pm和211pm两种。继续加热到250℃时测得压力为计算值的两倍。PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P—Cl的键长为198pm和206pm两种。(P、Cl相对原子质量为31.0、35.5)回答如下问题:(1)180℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。(2)在250℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。(3)PCl5熔体为什么能导电?用最简洁的方式作出解释。(4) PBr5气态分子结构与PCl5相似,它的熔体也能导电,但经测定其中只存在一种P-Br键长。PBr5熔体为什么导电?用最简洁的形式作出解释。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com