
| A. | 苯中含有少量甲苯 | B. | 乙醇中含有少量乙酸 | ||
| C. | 溴苯中含有少量苯 | D. | 乙酸乙酯中含有少量乙酸 |
分析 能用饱和Na2CO3溶液并借助于分液漏斗除去,说明混合物中有一种难溶于饱和碳酸钠,且加入饱和碳酸钠溶液后分离,用分液的方法分离,以此解答.
解答 解:A.苯、甲苯与饱和碳酸钠不反应,且不溶于饱和碳酸钠溶液,不能用分液的方法分离,故A错误;
B.乙醇以及乙酸钠都溶于水,不能用分液的方法分离,故B错误;
C.溴苯与苯混溶,与碳酸钠不反应,不能用达到分离的目的,故C错误;
D.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸可与碳酸钠反应,可用分液的方法分离,故D正确.
故选D.
点评 本题考查物质的分离和提纯的实验方案的设计与评价,为高频考点,侧重考查学生的分析能力和实验能力,题目难度不大,注意除杂时不能引入新的杂质,且不能影响被提纯物质的性质.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.015 | B. | 0.225 | C. | 0.035 | D. | 0.045 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:Li+<O2-<F-<Na+ | B. | 电负性:F>N>O>C | ||
| C. | 分子中的键角:CO2>H2O>CH4>NH3 | D. | 共价键的键能:H-F>H-Cl>H-Br>H-I |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
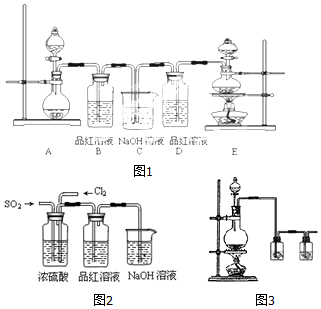
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
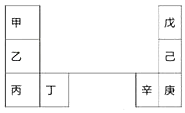 甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙和庚的原子核外电子数相差11 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
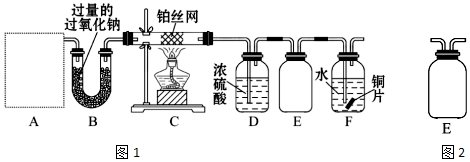
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com