
【题目】某同学用如图所示实验装置制取乙酸乙酯。回答以下问题:
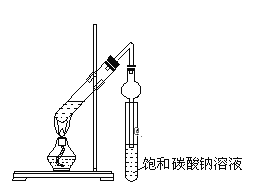
(1)在大试管中先加入3mL__,然后一边摇动一边慢慢地加入2mL___和2mL乙酸,混合均匀,然后加入几粒碎瓷片。按上图连好装置,用酒精灯对大试管小心均匀加热,当观察到明显现象时停止实验。
(2)加入浓硫酸的目的是:____,_____。
(3)加热前,大试管中加入几粒碎瓷片的作用是___。
(4)乙酸乙酯的密度比水____(填“大”或“小”),有___气味。
(5)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用有:①____,②___。
(6)饱和碳酸钠溶液的作用是____、____、____。
【答案】乙醇 浓H2SO4 催化剂 吸水剂 防止暴沸 小 芳香 防止倒吸 使乙酸乙酯充分冷凝 溶解乙醇 中和乙酸 降低乙酸乙酯的溶解度
【解析】
(1)乙酸乙酯制取实验时,应先加入乙醇,再加入浓硫酸,最后加入乙酸;
(2)浓硫酸在反应中作催化剂、吸水剂;
(3)加入几粒碎瓷片可防止液体剧烈沸腾;
(4)乙酸乙酯的密度比水小,并带有水果香味;
(5)干燥管内可盛有较多的液体,可防止倒吸,其与空气的接触面积增大,降低气体温度;
(6)饱和碳酸钠可中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度。
(1)乙酸乙酯制取实验时,应先加入乙醇,再加入浓硫酸,最后加入乙酸,若把乙醇加入浓硫酸时放出大量的热量,导致飞溅造成危险;
(2)浓硫酸在反应中作催化剂、吸水剂;
(3)加入几粒碎瓷片可防止液体剧烈沸腾;
(4)乙酸乙酯的密度比水小,并带有水果香味;
(5)用球形干燥管代替长导管时,干燥管内可盛有较多的液体,可防止倒吸,其与空气的接触面积增大,可使乙酸乙酯温度降低;
(6)饱和碳酸钠可与乙酸反应生成乙酸钠溶液,中和乙酸,还可溶解乙醇,降低乙酸乙酯的溶解度。


科目:高中化学 来源: 题型:
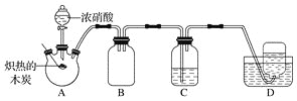
【题目】某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO3![]() 4NO2↑+O2↑+2H2O)。
4NO2↑+O2↑+2H2O)。
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至炽热状态,伸入三颈烧瓶中,生成的气体的颜色为__,产生该气体的反应的化学方程式是__。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为__(填化学式)。
(3)装置B的作用是__。
(4)装置D中收集到了无色气体,有同学认为是NO,还有同学认为是O2。
①下列对该气体的检验方法合适的是__(填字母)。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶内收集到的无色气体是氧气,则氧气的来源是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在工业、农业和国防科技中有重要应用,我国已是生产钢铁最多的国家。回答下列问题:
(1) 工业上以磁铁矿和焦炭为原料冶炼铁存在以下变化:
①Fe3O4(s)+4C(s)=3Fe(s)+4CO(g) ΔH1=+678kJ·mol-1 ②CO(g)+![]() O2(g)=CO2(g) ΔH2=-283kJ·mol-1
O2(g)=CO2(g) ΔH2=-283kJ·mol-1
③C(s) +![]() O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
则ΔH4=____kJ·mol-1。
(2)铁矿石中常含有硫, 使高炉尾气中混有SO2, 除去高炉尾气中SO2 的物质是___。生产中发现, 无论怎么改变原料配比与条件, 在高炉尾气中始终有CO, 原因是___。
(3)在温度 aK时,反应Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)的浓度平衡常数Kc=16(用浓度计算所得),则用分压(分压等于总压×体积分数)代替浓度算得的平衡常数Kp ___Kc(填 “大于”“小于” 或 “等于”)。平衡混合气体中CO的体积分数为___(保留两位有效数字)。
(4) aK 时,在体积为 2L 的密闭容器中,加入 Fe、 Fe3O4、 CO、 CO2各1.0mol,气体的压强为PkPa。
①此时,v 正(CO2) ___v 逆(CO)(填 “大于”“小于” 或 “等于”), 反应经过5min后达到平衡, 该时间范围内的平均反应速率 v(CO2)=___mol/(L·min)(保留两位有效数字)。
②已知:恒容条件下,相同分子数的气体,其压强与温度成正比。平衡后温度从 aK逐渐升高到3aK, 请在下图中绘制出CO分压(PCO的变化曲线)_______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.乙酸与乙醇的酯化反应:CH3COOH+C2H518OH![]() CH3COOC2H5+H218O
CH3COOC2H5+H218O
B.镁离子的结构示意图:![]()
C.二氧化碳分子的比例模型:![]()
D.NaCl溶液导电:NaCl![]() Na++Cl
Na++Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氮气和水蒸气为原料,电化学合成氨装置(电极不参与反应)示意图如下。下列说法不正确的是

A.电极a连接电源的正极B.OH向电极a迁移
C.电极b的电极反应:N2+6e+6H+= 2NH3D.总反应:2N2+6H2O(g)![]() 4NH3+3O2
4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
A. 0.6 molB. 2.8 molC. 1.4 molD. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究1,3-丁二烯和Br2以物质的量之比为1∶1加成时的反应:
![]() ;
;![]()
文献:Ⅰ.一般情况,在相同条件下,化学反应的活化能(E)越大,化学反应速率越小。
Ⅱ.1,3-丁二烯和Br2以物质的量之比为1∶1加成时的反应过程和能量变化的示意图如下:

(1)已知:
![]() ΔH1=-a(a>0) kJ·mol1 ;
ΔH1=-a(a>0) kJ·mol1 ; ![]() ΔH2=+c(c>0) kJ·mol1
ΔH2=+c(c>0) kJ·mol1
①稳定性:A ______ B(填“>”、“=”或“<”)。
②气态1,3-丁二烯和液态Br2以物质的量之比为1∶1加成生成液态B的热化学方程式是______。
(2)探究1,2-加成和1,4-加成的影响因素。
实验1 将1,3-丁二烯和Br2以物质的量之比1∶1加成,不同温度,相同时间内测定A和B在产物中的含量,低温时产物以A为主,较高温时以B为主。
实验2 加热实验1中低温时的反应产物,A的含量减少,B的含量增大。
实验3 在实验1的基础上,充分延长反应时间,无论是低温还是高温,产物中B的含量均增大。
①结合反应过程和能量变化的示意图,解释实验1中低温时产物以A为主的原因:______。
②说明实验2中,升高温度,A转化为B经历的物质转化过程:______。
③综上所述,有利于1,4加成的措施是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
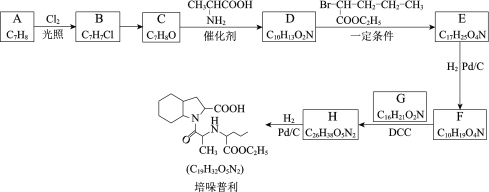
【题目】培哚普利主要用于治疗高血压与充血性心力衰竭,其合成路线如下:
已知:ⅰ. ![]()
ⅱ.DCC是一种很强的脱水剂。
(1)芳香烃A的名称是___________________。
(2)B→C所需的试剂及条件是________________。
(3)C→D的化学方程式是____________________。
(4)D→E的反应类型是______________________。
(5)F的结构简式是____________________________。
(6)K存在互变异构体K′,G可由如下路线合成:
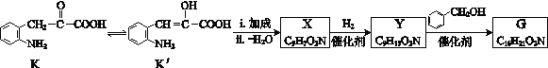
①X含有五元环和碳碳双键,其结构简式是______。
②上述合成培哚普利的路线中,将Y转化为G,再与F反应,而不直接用Y的主要目的是______,与合成路线中______________填字母)的转化目的相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁,其反应:Fe2O3(s)+3CH4(g)2Fe(s)+3CO(g)+6H2(g) ΔH,在容积固定且均为1L的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3(依次升高)且恒定不变,测得反应均进行到t min时CO的体积分数如图所示。下列说法正确的是( )
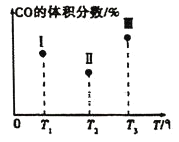
A.该反应的ΔH>0
B.容器Ⅲ中CO的体积分数可能为35%
C.容器中固体的质量不再改变,不能说明反应已达平衡状态
D.反应进行到tmin时,三个容器中一定达到平衡状态的是Ⅱ和Ⅲ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com