
【题目】C、N、S 的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2 的重整用 CO2 和 H2 为原料可得到 CH4 燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247kJ/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g) △H2=+205kJ/mol
写出 CO2 重整的热化学方程式:_____。
(2) “亚碳酸盐法”吸收烟中的 SO2
①将烟气通入 1.0mol/L 的 Na2SO3 溶液,若此过程中溶液体积不变,则溶液的 pH 不断_____(填“减小”“不变” 或“增大)。当溶液 pH 约为 6 时,吸收 SO2 的能力显著下降,应更换吸收剂,此时溶液中 c(SO32-) =0.2mol/L, 则溶液中 c(HSO3-) =_____。
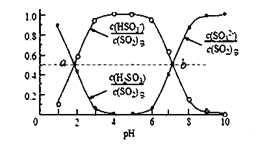
②室温条件下,将烟气通入(NH4)2SO3 溶液中,测得溶液 pH 与各组分物质的量分数的变化关系如图: b 点时溶液 pH=7,则 n(NH4+):n(HSO3—)= ______________ 。
(3)催化氧化法去除 NO。一定条件下,用 NH3 消除 NO 污染,其反应原理4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
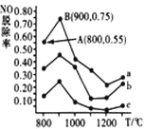
①曲线 a 中,NO 的起始浓度为6×10-4mg·m-3,从 A 点到 B 点经过0.8s,该时间段内 NO 的脱除速率为_____mg·m-3·s-1。
②曲线 b 对应 NH3 与 NO 的物质的量之比是_____。
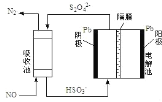
(4)间接电化学法除 NO。其原理如图所示:写出阴极的电极反应式(阴极室溶液呈酸性)_____。吸收池中除去 NO 的原理_____(用离子方程式表示)。
【答案】CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=163kJ/mo1 减小 1.6mol/L 3:1 1.5×104 3:1 ![]()
![]()
【解析】
(1)已知:①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247k/mol,
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+205k/mol,
根据盖斯定律,①-②×2得:CO2(g)+4H2(g)=CH4(g)+2H2O(g),据此计算△H;
(2)①二氧化硫通入亚硫酸钠溶液生成亚硫酸氢钠,亚硫酸氢钠显酸性,据此分析;根据反应方程式的量的关系计算可得;
②先判断溶质,写出电荷守恒式,在利用pH=7时,c(H+)=c(OH-)找出其他离子的等量关系,结合图示进行等量删减或替换,最后得出结果;
(3)①曲线a中,NO的起始浓度为6×10-4mgm-3,根据图象得到A、B处的NO脱除率,可得两处的NO的浓度,再计算脱除速率;
②NH3与NO的物质的量的比值越大,NO的脱除率越大,据此分析;
(4)阴极得到电子发生还原反应,结合酸性环境书写;阴极产物吸收NO。
(1)已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1=+247k/mol,
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+205k/mol,
根据盖斯定律,由①②×2得反应:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=△H12△H2=163kJ/mo1,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=163kJ/mo1;
(2)①将烟气通入1.0mol/L的Na2SO3溶液,二氧化硫与亚硫酸钠和水反应生成亚硫酸氢钠,亚硫酸氢钠以电离为主,显酸性,故溶液pH不断减小;向亚硫酸钠溶液中通入二氧化硫生成亚硫酸氢钠,反应方程式SO2+Na2SO3+2H2O=2NaHSO3,溶液中反应的亚硫酸根离子和生成亚硫酸氢根离子的物质的量比为1:2,即溶液中参加反应的亚硫酸根为(1.00.2)mol/L,则生成c(![]() )=2×(1.00.2)mol/L=1.6mol/L,
)=2×(1.00.2)mol/L=1.6mol/L,
故答案为:减小;1.6mol/L;
②b点时溶液pH=7,此时溶液中的溶质是(NH4)2SO3和NH4HSO3,根据电荷守恒:c(![]() )+c(H+)=c(OH)+c(
)+c(H+)=c(OH)+c(![]() )+2c(
)+2c(![]() ),因pH=7,故c(H+)=c(OH),则c(
),因pH=7,故c(H+)=c(OH),则c(![]() )=c(
)=c(![]() )+2c(
)+2c(![]() ),由图可读出b点时,c(
),由图可读出b点时,c(![]() )=c(
)=c(![]() ),则c(
),则c(![]() )=3 c(
)=3 c(![]() ),因在同一体系,n(
),因在同一体系,n(![]() ):n(
):n(![]() )=3:1,
)=3:1,
故答案为:3:1;
(3)①曲线a中,NO的起始浓度为6×104mgm3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8s,该时间段内NO的脱除速率为6×104mgm3×(0.750.55)÷0.8s=1.5×104mgm3s1,
故答案为:1.5×104;
②NH3与NO的物质的量的比值越大,NO的脱除率越大,则物质的量之比分别为4:1,3:1,1:3时,对应的曲线为a,b,c,即曲线b对应的物质的量之比是3:1,
故答案为:3:1;
(4)阴极得到电子发生还原反应,根据图可知是![]() 在酸性条件下发生还原反应,生成
在酸性条件下发生还原反应,生成![]() ,其电极反应式为
,其电极反应式为![]() ;根据图示,吸收池中
;根据图示,吸收池中![]() 和NO是反应物,N2和
和NO是反应物,N2和![]() 是生成物,则吸收池中除去NO的原理是:
是生成物,则吸收池中除去NO的原理是:![]() ,
,
故答案为:![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】近期发现,![]() 是继
是继![]() 、
、![]() 之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是__________(填标号)。
A. 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B. 氢硫酸的导电能力低于相同浓度的亚硫酸
C. ![]() 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的![]() 分别为
分别为![]() 和
和![]()
D. 氢硫酸的还原性强于亚硫酸
(2)![]() 与
与![]() 在高温下发生反应:H2S(g)+CO2(g)
在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.1mol
COS(g)+H2O(g)。在610K时,将0.1mol![]() 与
与![]()
![]() 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①![]() 的平衡转化率
的平衡转化率![]() ________%,反应平衡常数
________%,反应平衡常数![]() ___________________。
___________________。
②在620K重复实验,平衡后水的物质的量分数为0.03,![]() 的转化率
的转化率![]() ______
______![]() ,该反应的
,该反应的![]() ______0。(填“
______0。(填“![]() ”“
”“![]() ”或“
”或“![]() ”)
”)
③向反应器中再分别充入下列气体,能使![]() 转化率增大的是______(填标号)。
转化率增大的是______(填标号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是
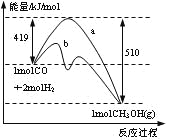
A. 该反应是吸热反应
B. 使用催化剂后反应热减小
C. 热化学方程式为CO(g)+2H2(g) = CH3OH(g)△H=-510 kJ·mol-1
D. 曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的应用前景。工业上采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
(1)下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.04 | 0.25 | 0.012 |
①由表中数据判断ΔH1 _________0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)=_______mol·L-1·min-1,该温度下此反应的平衡常数为___________,此时的温度为________(从上表中选择)。
(2)一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.恒容条件下充入He D.再充入适量的 H2
(3)为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
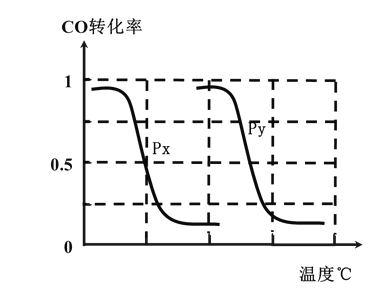
实验编号 | 温度(℃) | n(CO)/n(H2) | 压强(MPa) |
1 | a | 1/2 | 0.2 |
2 | 200 | b | 5 |
3 | 350 | 1/2 | 0.2 |
A.则上表中剩余的实验条件数据:a=________、b=_______。
B.根据反应I的特点,左下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Py=______MPa。
(4)上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:
①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的说法中,不正确的是( )。
A. 盐类的水解过程破坏了纯水的电离平衡
B. 盐类的水解是酸碱中和反应的逆反应
C. 盐类水解后的溶液不一定显中性
D. ![]() 溶液中,
溶液中, ![]() 是
是![]() 的两倍
的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:

(1)A点水的离子积为1×1014mol2/L2,B点水的离子积为_______.造成水的离子积变化的原因是________。
(2)100℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?_______ ; ______.
(3)100℃时,若盐酸中c(H+)=5×104mol/L,则由水电离产生的c(H+)是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是
①以上反应是可逆反应 ②以上反应不是可逆反应
③Cd为电池的正极 ④放电时化学能转变为电能.
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是:( )
物质 | X | Y | Z |
初始浓度/ | 0.1 | 0.2 | 0 |
平衡浓度/ | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增压使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka(HCOOH) =1.77×10—4,Ka(CH3COOH) =1.75×10—5,下列说法正确的是
A. pH均为3的HCOOH和盐酸等体积混合后,pH变小
B. 0.2 molL—1 CH3COONa 与 0.1 molL﹣1盐酸等体积混合后的溶液中(pH<7):c(CH3COO—)>c(Cl—)>c(CH3COOH)>c(H+)
C. 0.2 molL—1 HCOOH 与 0.1 molL—1 NaOH 等体积混合后的溶液中:c(HCOO—) +c(HCOOH) =0.2 molL—1
D. 中和浓度和体积均相同的HCOOH和CH3COOH,所用NaOH的物质的量不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com