
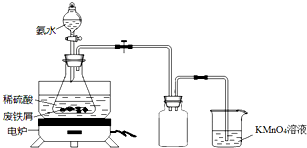
 某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
分析 (1)氨水不稳定,见光受热易分解,需密封、冷暗处保存;
(2)由于废铁屑中含有含S元素的物质,加入稀硫酸,会产生硫化氢等有毒气体,不能向空气中排放;
(3)稀硫酸与氨水的反应,生成硫酸铵和水,氨水为弱碱,不能拆;
(4)由于Fe2+有较强的还原性,为弱碱阳离子,实验过程中要防止二价铁被氧气氧化和水解;
(5)步骤Ⅰ为硫酸亚铁铵晶体与饱和草酸溶液反应生成黄色沉淀(FeC2O4•2H2O,据此写出方程式;
(6)温度太高,H2O2分解;温度太低,Fe2+氧化速度太慢;
(7)因为25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)+3C2O42-(aq) K=10-16.2,平衡常数小于10-5,离子浓度太小,观察不到明显现象,所以无法检验;
(8)根据方程式3C2O42-+14H++Cr2O72-=2Cr3++6CO2↑+7H2O进行计算,注意250mL中取25mL,但计算的是原晶体中的含量.
解答 解:(1)由于氨水不稳定,见光受热易分解,故实验室保存氨水的方法为密封保存,置于冷暗处,故答案为:密封保存,置于冷暗处;
(2)由于废铁屑中含有含S元素的物质,加入稀硫酸,会产生硫化氢等有毒气体,不能向空气中排放,高锰酸钾溶液的作用是吸收H2S等尾气,防止污染空气,故答案为:吸收H2S等尾气,防止污染空气;
(3)锥形瓶中是冷切后的溶液中稀硫酸与氨水的反应,生成硫酸铵和水,氨水为弱碱,不能拆,离子方程式为NH3•H2O+H+=NH4++H2O,故答案为:NH3•H2O+H+=NH4++H2O;
(4)由于Fe2+有较强的还原性,实验过程中要防止二价铁被氧气氧化,保持铁屑过量就是防止亚铁离子被氧化;二价铁离子在溶液中要水解,故需抑制其水解,加入稀硫酸可以增大氢离子浓度,抑制亚铁离子的水解,因此要确保获得浅绿色悬浊液,可选择ab,故答案为:ab;
(5)步骤Ⅰ为硫酸亚铁铵晶体与饱和草酸溶液反应生成黄色沉淀(FeC2O4•2H2O),化学方程式为(NH4)2SO4•FeSO4•6H2O+H2C2O4=FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O,故答案为:(NH4)2SO4•FeSO4•6H2O+H2C2O4=FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O;
(6)温度太高,H2O2分解;温度太低,Fe2+氧化速度太慢,故水浴加热控制在40℃是防止过氧化氢分解和确保二价铁被氧化为三价铁的反应速率,故答案为:温度太高,H2O2分解;温度太低,Fe2+氧化速度太慢;
(7)因为25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)+3C2O42-(aq) K=10-16.2,平衡常数小于10-5,离子浓度太小,观察不到明显现象,所以无法检验,故答案为:否,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于10-5,观察不到明显现象,所以无法检验;
(8)根据反应,25mL标准液消耗c mol•L-1K2Cr2O7V mL,物质的量为cV×10-3mol,设有C2O42-的质量为x,根据方程式
3C2O42-+14H++Cr2O72-=2Cr3++6CO2↑+7H2O
3×88g 1mol
x cV×10-3mol
x=264cV×10-3g,故250mL中含有的质量为264cV×10-2g,晶体中C2O42-质量分数的表达式为=$\frac{264cV}{m}%$,故答案为:$\frac{264cV}{m}%$.
点评 本题考查物质的制备原理和操作方法,需要学生阅读题目获取信息的能力、氧化还原反应及计算等,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力,注意基础知识的全面掌握.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.4mol/(L•s) | D. | v(D)=0.45mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯、丙烯、丁烯的混合气体中所含原子数为3NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 46g乙醇中含有C-H键数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
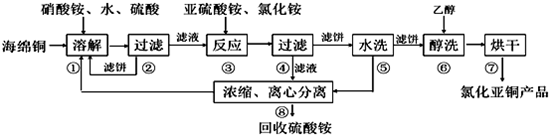
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
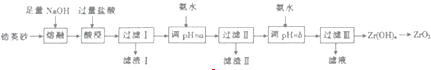
| 离子 | Fe3+ | AP+ | ZrO2+ |
| 开始沉淀pH | 1.9 | 3.3 | 6.2 |
| 完仝沉淀pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

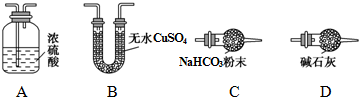
| 乙装置的质量(g) | 丙装置的质量(g) | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .其反应类型为消去反应.检验生成的乙烯要将气体先后通入氢氧化钠溶液、酸性高锰酸钾溶液或溴水中.(填试剂名称)
.其反应类型为消去反应.检验生成的乙烯要将气体先后通入氢氧化钠溶液、酸性高锰酸钾溶液或溴水中.(填试剂名称)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com