
| A. | 392.93 kJ | B. | 2 489.42 kJ | C. | 784.92 kJ | D. | 3 274.3 kJ |
分析 100g炭完全燃烧相比,损失的热量是生成了一氧化碳导致的,可以先根据碳原子守恒和体积比为1:2计算出CO和CO2的物质的量,根据一氧化碳的物质的量,计算出一氧化碳燃烧成二氧化碳放出的热量就是损失的热量,以此解答该题.
解答 解:100 g C的物质的量为$\frac{100g}{12g/mol}$=$\frac{25}{3}$mol.所以CO的物质的量为$\frac{25}{3}$mol×$\frac{1}{3}$=$\frac{25}{9}$mol.故损失的热量为282.57 kJ/mol×$\frac{25}{9}$mol≈784.92 kJ,故选C.
点评 本题主要考查反应热的计算,为高频考点,侧重考查学生的分析能力以及盖斯定律的原理理解运用,本题关键点是碳不完全燃烧损失的热量为生成的一氧化碳燃烧放出的热量,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | A、B的单质与盐酸反应的速率:B>A | B. | B的氧化物具有两性 | ||
| C. | C和E在常温下可发生化学反应 | D. | A和E能形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将乙醇与浓硫酸反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B | 检验淀粉水解产物的还原性 | 取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现浅黄色色沉淀 |
| D | 证明溴乙烷消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体先通过盛有水的洗气瓶再通入酸性高锰酸钾溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +CH3OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3OH$?_{△}^{浓H_{2}SO_{4}}$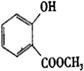 +H2O.反应类型是取代反应.
+H2O.反应类型是取代反应.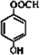 或
或 .
. )的合成路线(无机原料任选).
)的合成路线(无机原料任选). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3(CH2)4CH3 己烷 | B. | (CH3)2CHCH(CH3)2 2,3-二甲基丁烷 | ||
| C. | (C2H5)2CHCH3 2-乙基丁烷 | D. | C2H5C(CH3)3 2,2-二甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验数据 实验序号 | (NH4)2Fe(SO4)2溶液体积读数/mL | |
| 滴定前 | 滴定后 | |
| 第一次 | 0.30 | 15.31 |
| 第二次 | 0.20 | 15.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
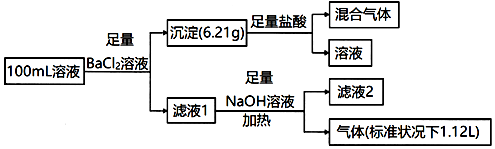
| A. | 该溶液中Ca2+、SO42-一定不存在,Na+、K+至少存在一种 | |
| B. | 溶液中c(SO32-)=0.15 mol•L-1,且c(NH4+)>c(CO32-) | |
| C. | 若该溶液中存在Cl-,则原溶液中c(Na+)≤0.25 mol•L-1 | |
| D. | 取少量滤液2,加入硝酸酸化,再滴加硝酸银溶液,有白色沉淀生成,证明原溶液中含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com