
【题目】【湖南省2017年考前演练卷(三)】利用下列实验装置进行相应的实验,不能达到实验目的的是

A.利用图甲装置,可快速制取氨气
B.利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C.利用图丙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D.利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
【答案】C
【解析】A.生石灰与水反应放出大量的热,浓氨水受热发生分解生成氨气,所以利用图甲装置可快速制取氨气,所以A是正确的;B.乙醇易溶于水,乙酸乙酯不溶于饱和碳酸钠溶液,所以可以利用图乙装置,乙醇用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液,B正确;C.乙醇和浓硫酸混合加热到170℃时发生反应,生成乙烯,但是如果加热到140℃,生成的是乙醚。图丙装置中缺少温度计控制反应温度,C不正确;D.浓硫酸可使蔗糖脱水碳化,这个过程放出大量的热,碳被浓硫酸氧化生成二氧化碳,浓硫酸被还原为二氧化硫,二氧化硫可使品红溶液褪色,可使酸性高锰钾溶液褪色。所以利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性,D正确。


科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅱ]水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2![]() +I2=2I+
+I2=2I+![]() )。
)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)“氧的固定”中发生反应的化学方程式为_______________。
(3)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取100.00 mL水样经固氧、酸化后,用a mol·L1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_________mg·L1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【合肥市2017届第三次模拟考试】对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
Ⅰ.CO还原法
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应_______(填“放出”或“吸收”)的热量为_________。
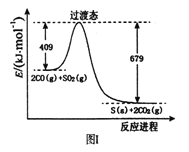
(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g)![]() S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
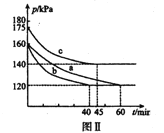
Ⅱ.Na2SO3溶液吸收法
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。
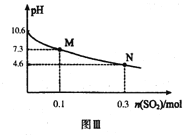
(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是____
A.NH3·H2O B.Na2S C.Na2CO3 D.FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡水中学2017届第二次模拟】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
sabatior反应:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g) + O2(g)
2H2(g) + O2(g)
(1)将原料气按nCO2∶nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
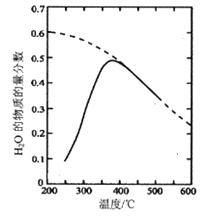
①己知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、BkJ/mol, H2O(l)=H2O(g) △H =C kJ/mol。计算Sabatier反应的△H=___kJ/mol。
②温度过高或过低均不利于该反应的进行,原因是________。
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压 B.增大催化剂的比表面积
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3) 一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
在250℃,向体积为2L且带气压计的恒容密闭容器中通入0.08molH2和0.04molCO2发生Bosch 反应CO2(g)+2H2(g)![]() C(s)+2H2O(g) △ H
C(s)+2H2O(g) △ H
①若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图I 曲线a所示,则△H___ 0(填“>”“<”或“不确定”) ;若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I 曲线b所示,则改变的条件是______________。
②图II是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____________(填“甲”或“乙”):m值为____________。

③Bosch反应必须在高温下才能启动,原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列五组物质,其中一定互为同分异构体的组是( )
①淀粉和纤维素 ②硝基乙烷 C2H5NO2和甘氨酸NH2CH2COOH ③乙酸和乙二酸 ④二甲苯和苯乙烯 ⑤2-戊烯和环戊烷
A.①②B.②③④C.①③⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届株洲市上学期教学质检】甲、乙、丙、X是中学化学中常见的4种物质,其转化关系如图,其中甲和X不可能是

A.甲为C2H5OH、X为O2 B.甲为H2S、X为O2
C.甲为HNO3 、X为Fe D.甲为AlCl 3 溶液、X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,错误的是( )
A. 钠和冷水反应:2Na+2H2O═2Na++2OH﹣+H2↑
B. AlCl3溶液中加入足量的氨水:Al3++4OH﹣═AlO2﹣+2H2O
C. 将氯气通入水中:Cl2+H2O![]() Cl﹣+HClO+H+
Cl﹣+HClO+H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,错误的是
A.制钠:以海水为原料制得NaCl,再电解熔融NaCl得钠
B.制铁:以焦炭和铁矿石为原料,用CO还原铁矿石得铁
C.制硅:用焦炭还原二氧化硅得硅
D.制镁:以海水为原料,经一系列过程制得氯化镁,用H2还原MgCl2得镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+===Ca2++H2O+CO2↑
B. 向CuSO4溶液中加入NaOH溶液:Cu2++2OH-===Cu(OH)2↓
C. 将Cu丝插入AgNO3溶液中:Cu+Ag+===Cu2++Ag
D. 向Ba(OH)2溶液中逐滴加入KHSO4溶液至溶液呈中性:H++SO![]() +Ba2++OH-===H2O+BaSO4↓
+Ba2++OH-===H2O+BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com