
| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
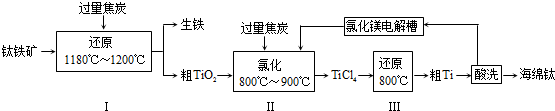
分析 钛铁矿(主要成分为FeTiO3,含少量Fe2O3)制备钛,钛铁矿加入过量焦炭在高温下还原生成铁和粗TiO2,加入过量焦炭在高温下氯化反应生成TiCl4,加入还原剂还原生成金属钛,酸洗后得到海绵钛;
(1)增大接触面积加快反应速率;
(2)步骤Ⅰ中所发生的主要反应是FeTiO3在高温下被碳还原生成二氧化钛、铁,碳被氧化为一氧化碳;
(3)步骤Ⅱ中所发生的主要反应是二氧化钛和氯气、碳高温发生氧化还原反应生成四氯化钛和一氧化碳,加入焦炭后发生反应①,与反应②相比,△H减小,△S增大;
(4)TiCl4遇到水易发生水解,用盐酸洗涤粗Ti,除去表面的杂质.
解答 解:钛铁矿(主要成分为FeTiO3,含少量Fe2O3)制备钛,钛铁矿加入过量焦炭在高温下还原生成铁和粗TiO2,加入过量焦炭在高温下氯化反应生成TiCl4,加入还原剂还原生成金属钛,酸洗后得到海绵钛;
(1)进行步骤Ⅰ前,钛铁矿需要先粉碎成细颗粒,目的为增大接触面积增大反应速率,
故答案为:增大反应速率;
(2)步骤Ⅰ中所发生的主要反应是FeTiO3在高温下被碳还原生成二氧化钛、铁,碳被氧化为一氧化碳,反应的化学方程式为:FeTiO3+C$\frac{\underline{\;1180℃-1200℃\;}}{\;}$Fe+TiO2+CO↑;
故答案为:FeTiO3+C$\frac{\underline{\;1180℃-1200℃\;}}{\;}$Fe+TiO2+CO↑;
(3)步骤Ⅱ中所发生的主要反应是二氧化钛和氯气、碳高温发生氧化还原反应生成四氯化钛和一氧化碳,①的化学方程式为:TiO2+2Cl2+2C $\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO,图表数据分析可知加入焦炭后发生反应①,与反应②相比,△H减小,△S增大,更有利于反应在较低温度下向右进行,
故答案为:TiO2+2Cl2+2C $\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO;加入焦炭后发生反应①,与反应②相比,△H减小,△S增大,更有利于反应在较低温度下向右进行;
(4)步骤Ⅲ中,反应物TiCl4应避免接触水,原因为防止TiCl4水解,反应结束后,用盐酸洗涤粗Ti,除去Mg、MgCl2等杂质,制得海绵钛,
故答案为:防止TiCl4水解;Mg、MgCl2.
点评 本题考查学生阅读题目获取信息能力、氧化还原反应、绿色化学、物质分离提纯等,难度中等,注意基础知识的掌握利用.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 等质量NaHCO3和Na2CO3的分别与足量盐酸完全反应,Na2CO3产生的CO2少 | |
| B. | 84g NaHCO3、106g Na2CO3分别与同浓度足量盐酸完全反应,Na2CO3消耗盐酸的是NaHCO3两倍 | |
| C. | 将澄清石灰水、CaCl2溶液分别倒入两种盐溶液中,都只有Na2CO3产生沉淀 | |
| D. | 通常情况下,Na2CO3的溶解度大于NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、Cl-、NO${\;}_{3}^{-}$ | B. | H+、Na+、Cl-、CO32- | ||
| C. | Na+、Ag+、Cl-、OH- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水 | |
| B. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | 氯化铝是一种电解质,可用于电解法制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法计算 | B. | 5.6g | C. | 2.8g | D. | 0.56 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com