
| A、X2气过量 |
| B、X2气Y2气各50mL |
| C、产物是双原子分子 |
| D、无法作出上述判断 |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
| A、Y和Z均由元素R组成,反应Y+2I-+2H+=I2+Z+H2O,其中的R元素在地壳中含量位居第一 |
| B、F2、C2H4、Na2O2、C2H6、H2O2都是含有非极性键的共价化合物 |
| C、锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+Li=LixV2O5.供电时Li+向正极移动,充电时阳极的电极反应式为:LixV2O5-xe-=V2O5+xLi+ |
| D、常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
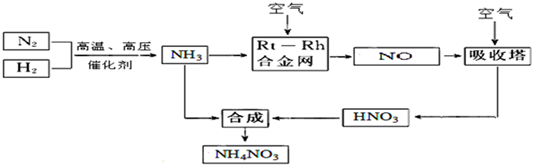
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,相同体积的物质,其物质的量一定相等 |
| B、任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
| C、相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等 |
| D、1L一氧化碳气体一定比1L氧气的质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下在c(H+)=1×10-13mol/L的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3- |
| B、使甲基橙试液变红的溶液中可能大量存在Na+、ClO?、SO42?、I? |
| C、使PH试纸变蓝的溶液中可大量存在Na+、K+、AlO2-、CO32- |
| D、常温下,在水电离产生的c(H+)×c(OH-)=1×10-24的溶液中可大量存在Fe2+、Cl-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
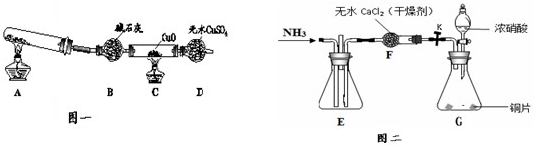
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com