

| A.两种分子中心原子的杂化类型不同 |
| B.两种分子中键的极性和分子的极性不同 |
| C.NH3分子中存在有一对未成键的孤对电子 |
| D.氨气分子之间和甲烷分子之间的作用力类型不同 |
科目:高中化学 来源:不详 题型:单选题
| A.氯化钠 | B.二氧化硅 | C.干冰 | D.二氧化硫 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.都不正确 | B.只有①③⑤正确 |
| C.只有②④⑤正确 | D.只有①②⑥正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 杂化,其键角比水分子 (填“大”或“小”)。
杂化,其键角比水分子 (填“大”或“小”)。
 氢键的“键能”)是 kJ / mol 。
氢键的“键能”)是 kJ / mol 。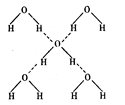
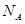 表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
表示阿伏加德罗常数,则CaO晶胞体积为 cm3。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.组成纳米材料的结构粒子是纳米量级的原子团 |
| B.二氧化硅晶体中,每个Si原子与4个氧原子形成共价键,故晶体中硅、氧原子个数比为1∶4 |
| C.NaI与NaCl晶体比较,NaI的离子间距更大,晶格能的绝对值更小,熔点更低 |
| D.等离子体中的微粒带有电荷且能自由运动,使等离子体具有很好的导电性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同周期元素中X的金属性最强 | B.同族元素中Z的氢化物沸点最高 |
| C.原子半径X>Y,离子半径X+> Z2— | D.Y的单质和氧化物有相同的晶体类型 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
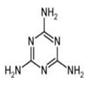
| A.一个分子中共含有15个σ键 |
B.所 有碳原子采用sp2杂化,所有氮原子采用sp3杂化 有碳原子采用sp2杂化,所有氮原子采用sp3杂化 |
| C.属于极性分子,故极易溶于水 |
| D.形成的晶体熔点较高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com