
【题目】t ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1。已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数Kw=________________。
(2)该溶液中由水电离出的c(OH-)=_________________。
(3)该温度下,将NH3溶于水得100 mL 0.1 mol·L-1的氨水,测得pH=9,则该条件下,NH3· H2O的电离平衡常数Kb为______________________。
【答案】10-12 10-a mol·L-1 10-5
【解析】
由Kw= c(H+)×c(OH-)计算水的离子积常数,再根据水电离出的氢氧根离子浓度等于水电离出的氢离子浓度,判断NaOH溶液中水电离出的氢氧根离子浓度,最后根据Kb=![]() 计算NH3· H2O的电离平衡常数。
计算NH3· H2O的电离平衡常数。
(1). 该温度下水的离子积常数Kw= c(H+)×c(OH-)=10-a mol·L-1×10-b mol·L-1=10-(a+b)= 10-12,故答案为:10-12;
(2). 在NaOH稀溶液中,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度,所以由水电离出的氢氧根离子浓度为10-a mol·L-1,故答案为:10-a mol·L-1;
(3). 该温度下,将NH3溶于水得100 mL 0.1 mol·L-1的氨水,测得pH=9,由NH3·H2O的电离方程式NH3·H2O![]() NH4++OH-可知,NH3·H2O的电离平衡常数Kb=
NH4++OH-可知,NH3·H2O的电离平衡常数Kb=![]() =
=![]() =10-5,故答案为:10-5;
=10-5,故答案为:10-5;


科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是
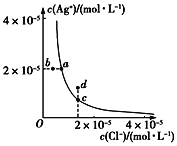
A. 加入AgNO3可以使溶液由c点变到d点
B. 加入固体NaCl,则AgCl的溶解度减小,Ksp也减小
C. d点有AgCl沉淀生成
D. a点对应的Ksp小于b点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1.56×10-10。如图是向10 mL AgNO3溶液中逐渐加入0.1 mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]

A. 原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B. 图中x点的坐标为(100,6)
C. 图中x点表示溶液中Ag+恰好完全沉淀
D. 把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中错误的是( )
A. 加入含有NaOH的酚酞溶液,红色褪去,说明有H+存在
B. 加入有色布条后,有色布条退色,说明有HClO分子存在
C. 氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
D. 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.2mol Na2SO4能电离出___个Na+,0.04mol某物质的质量为7.2g,则该物质的摩尔质量为___。
(2)等物质的量的CO和CO2中所含O原子物质的量之比___,二者的质量之比___。
(3)下列物质中,物质的量最大的是__(填字母,下同);含原子个数最多的是___。
A.6g H2 B.0.5mol CO2 C.1.204×1024个HCl分子 D.98g H2SO4 E.92g 乙醇(C2H5OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空。
(1)在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为___。
(2)将3.22g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为__g。
(3)在干燥烧瓶中用向下排空气法收集氨气,由于空气不可能排净,所以瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积的_______。
(4)100mL 0.3mol/L Na2SO4(密度为d1 g/cm3)和50mL 0.2mol/L Al2(SO4)3(密度为d2 g/cm3)混合,所得密度为d3 g/cm3的混合溶液中SO42-的浓度为___________。(用含d1,d2, d3的式子表示)
(5)已知两种碱AOH和BOH的摩尔质量之比为5:7,现将7mol AOH与5mol BOH混合后,从中取出5.6g,恰好可以中和100ml浓度为1.2mol/L的盐酸,则AOH的摩尔质量为_____。
(6)标准状况下,用一定量的水吸收HCl气体后制得浓度为1.0mol/L,密度为1.0365g/cm-3的盐酸。请计算1体积水吸收_______体积的HCl可制得上述氨水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌空气燃料电池可用作电动车电源,电解质溶液为KOH溶液,正向放电,逆向充电,总反应为:Zn+O2+4OH-+2H2O ![]() 2Zn(OH)42-,下列说法正确的是
2Zn(OH)42-,下列说法正确的是
A. 充电时,电解质溶液中K+向阳极移动
B. 充电时,电解质溶液中c(OH-)逐渐减小
C. 放电时,负极反应为:Zn+4OH--2e-===Zn(OH) 42-
D. 可用盐酸代替KOH作电解液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com