
| A、在FeCl3溶液中投入足量的Zn粉:2Fe3++Zn═Zn2++2Fe2+ |
| B、NaHSO4溶液与Ba(OH)2溶液混合后呈中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| C、磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| D、Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |


科目:高中化学 来源: 题型:
 已知某温度下CH3COOH的电离常数K=1.6×10-5.该温度下向20mL 0.01mol?L-1CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化).请回答下列有关问题:
已知某温度下CH3COOH的电离常数K=1.6×10-5.该温度下向20mL 0.01mol?L-1CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化).请回答下列有关问题: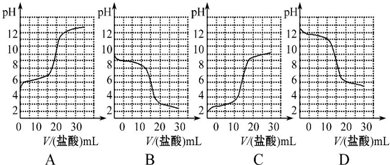
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 在某钠盐溶液中滴加稀硫酸 | 产生能使石灰水变浑浊的气体 | 该溶液一定含有CO32-或HCO3- |
| B | KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变蓝色 | KIO3的氧化性比I2强 |
| C | 在Na2S溶液中滴加盐酸 | 产生臭鸡蛋气味的气体 | 氯的非金属性比硫的非金属性强 |
| D | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液 | 溶液不显红色 | 黑色固体中无Fe3O4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、③④⑤ |
| C、②③④ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2=Ca2++2Cl- |
| B、H2CO3?H++HCO3- |
| C、NaHCO3=Na++H++CO32- |
| D、NaClO=Na++ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水、过氧化氢和干冰都属于氧化物 |
| B、NaHSO4、CuSO4和KMnO4都属于盐 |
| C、烧碱、纯碱、熟石灰都属于碱 |
| D、H2SO4、HNO3、H2CO3都属于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇与2mol?L-1的硫酸溶液混合加热到170℃制乙烯 |
| B、苯与溴水反应制取溴苯 |
| C、要鉴别己烯中是否混有少量甲苯,最恰当的实验方法是先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| D、电石与饱和食盐水作用制乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量是一个基本物理量,表示物质所含粒子的多少 |
| B、1mol氢中含有2mol氢原子和2mol电子 |
| C、1molH2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数) |
| D、摩尔表示物质的量的数量单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:
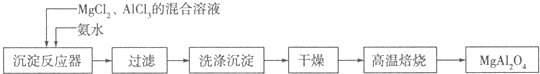

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com