
【题目】为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10mol/LKHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 。
(3) 完成并配平下列离子方程式:
C2O42- + MnO4—+ H+ = CO2↑+ Mn2+ +
(4)步骤③中判断滴定终点的方法是 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)试样中H2C2O4·2H2O的质量分数为 。
【答案】(1)c(HC2O4-)>c(C2O42-)>c(H2C2O4)
(2)胶头滴管、250mL容量瓶、(量筒)
(3)5、2、16、10、2、8H2O
(4)溶液由无色变为浅红色(或紫色、紫红色),且半分钟内不褪色
(5)偏小
(6)21%
【解析】
试题分析:(1)0.10mol/L KHC2O4溶液pH约为3,溶液显酸性,草酸氢根离子电离大
于水解,则含碳元素的粒子浓度由大到小的顺序为:c(HC2O4-)>c(C2O42-)>c(H2C2O4)。
故答案为:c(HC2O4-)>c(C2O42-)>c(H2C2O4);
(2)步骤①是称量、溶解,配制,所需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL
容量瓶、量筒等。
故答案为:胶头滴管;250mL量瓶;
(3)化合价C:+3→+4,改变量(4-3)×2=2,Mn:+7→+2,改变量(7-2)×1=5,
根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,根据电荷守恒,在H+前配16,最后根据离子方程式两边的H个数相等,结合原子守恒得到在水前面配8,经检验离子方程式两边的氧原子相等,得到离子方程式为:C2O42++2MnO4-+16H+=10CO2+8Mn2++8H2O。
故答案为:5;2;16;10;2;8H2O;
(4)原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变。
故答案为:滴入最后一滴溶液呈紫红色且半分钟内不褪色;
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则导致试样溶液浓度被稀释,所以消耗氢氧化钠溶液的体积减少,所以测得的H2C2O4·2H2O的质量分数偏小。
故答案为:偏小;
(6)由于实验时所取溶液均为配制时的![]() ,所以①、②中计算的数据均为配置溶液中溶质的
,所以①、②中计算的数据均为配置溶液中溶质的![]() ,由①得:2n(H2C2O42H2O)+n(KHC2O4)=0.05mol,由②得:n(H2C2O42H2O)+n(KHC2O4)=0.04mol,由上述两个方程式得:n(H2C2O42H2O)=0.01mol,n(KHC2O4)=0.03mol;H2C2O42H2O的质量分数为:
,由①得:2n(H2C2O42H2O)+n(KHC2O4)=0.05mol,由②得:n(H2C2O42H2O)+n(KHC2O4)=0.04mol,由上述两个方程式得:n(H2C2O42H2O)=0.01mol,n(KHC2O4)=0.03mol;H2C2O42H2O的质量分数为:![]() ×100%=21%。
×100%=21%。
故答案为:21%。


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】每年的6月26日是国际禁毒日,珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是
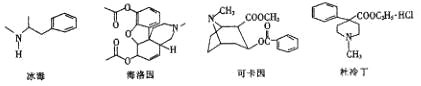
A. 冰毒的摩尔质量为149
B. 海洛因和杜冷丁均能与溴水发生加成反应
C. 1mol可卡因最多能与2molNaOH发生反应
D. 以上毒品均属于芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应平衡常数表达式为K![]() 。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是( )
。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是( )
A.反应的热化学方程式为![]() +SO3(g)△H>0
+SO3(g)△H>0
B.一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深
C.混合气体的平均摩尔质量保持不变,说明反应已达平衡
D.使用合适的催化剂可使该反应的反应速率和平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届江苏苏中三市二调】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (15分)研究证明,高铁酸钾不仅能在饮用水源和废水处理过程中去除污染物,而且不产生任何诱变致癌的产物,具有高度的安全性。湿法制备高铁酸钾是目前最成熟的方法,实验步骤如下:
A.直接用天平称取60.5gFe(NO3)3·9H2O、30.0gNaOH、17.1gKOH。
B.在冰冷却的环境中向NaClO溶液中加入固体NaOH并搅拌,又想其中缓慢少量分批加入Fe(NO3)3·9H2O,并不断搅拌。C.水浴温度控制在20℃,用电磁加热搅拌器搅拌1.5h左右,溶液成紫红色时,即表明有Na2FeO4生成。
D.在继续充分搅拌的情况下,向上述的反应液中加入固体NaOH至饱和。
e.将固体KOH加入到上述溶液中至饱和。保持温度在20℃,并不停的搅拌15min,可见到烧杯壁有黑色沉淀物生成,即K2FeO4.
(1)①步骤b中不断搅拌的目的是_______。②步骤c中发生反应的离子方程式为______。③由以上信息可知:高铁酸钾的溶解度比高铁酸钠_______(填“大”或“小”)。
(2) 高铁酸钾是一种理想的水处理剂,与水反应生成O2、Fe(OH)3(胶体)和KOH。① 该反应的离子方程式为______。②高铁酸钾作为水处理剂发挥的作用是_______。③ 在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______。
A.H2O B.稀KOH溶液、异丙醇 C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(3) 高铁酸钠还可以用电解法制得,其原理可表示为Fe+2NaOH+2H2O![]() 3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
(4)25℃时,Ksp(CaFeO4)=4.536×10-9,若要使100mL1.0×10-3mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,理论上要加入Ca(OH)2的物质的量为_____mol。
(5)干法制备高铁酸钾的方法是Fe2O3、KNO3、KOH混合加热共熔生成黑色高铁酸钾和KNO2等产物。则该方法中氧化剂与还原剂的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于水的电离平衡叙述不正确的是( )
A.将水加热,pH减小
B.恒温下,向水中加入少量固体KOH,Kw不变
C.向水中加入金属钠,c(H+)减小
D.向水中通入氯化氢气体,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A. NH3易液化,液氨常用作制冷剂
B. 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C. 铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
D. 稀HNO3和活泼金属反应时主要得到NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com