
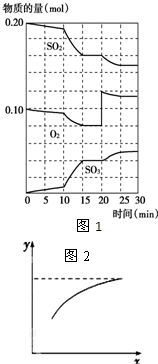
 硫酸生产中,接触室内的反应为:
硫酸生产中,接触室内的反应为:
| ||
| △ |
| X | y | |
| A | 再加入SO2 | O2的转化率 |
| B | 再加入SO3 | SO2的体积分数 |
| C | 压强 | 混合气体的物质的量 |
| D | 温度 | 混合气体的平均摩尔质量 |
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投入量 | 2mol SO2+ 1mol O2 | 1mol SO2+ 0.5mol O2 | 2mol SO3 | 2mol SO2+ 2mol O2 |
| 反应放出或 吸收的热量(kJ) | a | b | c | d |
| 平衡时c(SO3)(mol/L) | e | f | g | h |
| △c |
| △t |
| 2mol-1.6mol |
| 2mol |
| △c |
| △t |
| 0.4mol |
| 1L |
| 1.6mol |
| 1L |
| 0.8mol |
| 1L |
| 0.8×1.62 |
| 0.42 |
| 1.8 |
| 2 |
| 0.2mol |
| 0.9mol |
| 2 |
| 9 |
| 2 |
| 9 |


科目:高中化学 来源: 题型:
| A、0.21 mol?L-1 |
| B、0.56 mol?L-1 |
| C、0.24 mol?L-1 |
| D、0.12 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)按要求写出下列反应方程式:
(1)按要求写出下列反应方程式: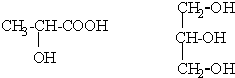
查看答案和解析>>
科目:高中化学 来源: 题型:
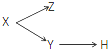
| X | Y | Z | H | |
| A | 分散系 | 胶体 | 溶液 | 烟 |
| B | 电解质 | 酸 | 碱 | 盐 |
| C | 元素周期表的纵列 | 主族 | 副族 | 卤族 |
| D | 化合物 | 共价化合物 | 离子化合物 | 酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
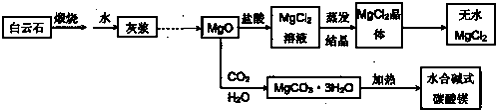
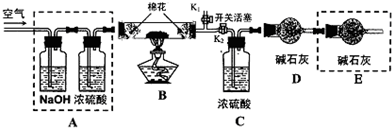
查看答案和解析>>
科目:高中化学 来源: 题型:
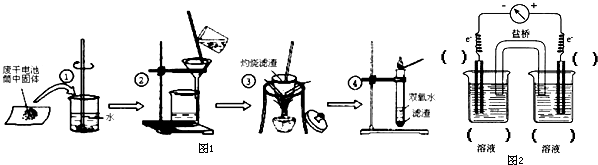
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
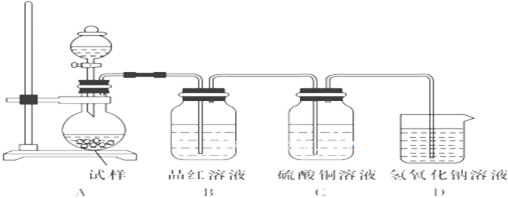
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com