
本题由两部分组成
Ⅰ通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.?
| 化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
O=O |
| 键能/kJ?mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
498 |
请回答下列问题:?
(1)比较下列两组物质的熔点高低(填“>”或“<”):SiC
>
>
Si;SiCl
4<
<
SiO
2.
(2)工业上用高纯硅可通过下列反应制取:SiCl
4(g)+2H
2(g)
Si(s)+4HCl(g),该反应的反应热△H=
+236
+236
kJ?mol
-1.
(3)请把如图表示固体Si在O
2中完全燃烧生成SiO
2固体的能量变化图补充完整.
Ⅱ某实验小组设计下列实验
A 分别配制250mL 1.0mol/L盐酸跟和250mL 1.1mol/L氢氧化钠溶液.
B 每次分别取用上述配制的盐酸50mL跟和氢氧化钠50mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:?
(1)为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、
250mL容量瓶(2个),还缺少的仪器有
胶头滴管
胶头滴管
进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有
环形玻璃搅拌棒和温度计
环形玻璃搅拌棒和温度计
.
(2)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H
偏大
偏大
(填“偏大”、“偏小”或“无影响”);
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.?
| 实验序号 |
起始温度t1/℃ |
终止温度t2/℃ |
温差(t2-t1)
/℃ |
| 盐酸 |
NaOH溶液 |
平均值 |
| 1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
| 2 |
25.1 |
25.1 |
31.8 |
31.8 |
6.7 |
| 3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm
3,中和后混合液的比热容C=4.18×10
-3kJ/(g?℃),则该反应的热化学反应方程式为
HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq);△H=-56.01kJ/mol
HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq);△H=-56.01kJ/mol
.?

 导学全程练创优训练系列答案
导学全程练创优训练系列答案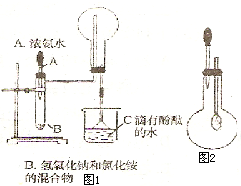 如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:
如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题: 本题由两部分组成
本题由两部分组成

 为定性探究乙醇的性质,某化学课外小组通过查阅资料并设计了实验方案进行探究.
为定性探究乙醇的性质,某化学课外小组通过查阅资料并设计了实验方案进行探究.