
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池充电过程中,阴极附近溶液的pH降低 |
| D、电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑤⑥⑦ | B、③④⑦ |
| C、②③④⑦ | D、①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
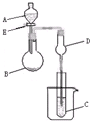 一个装置有多种用途是化学实验中经常出现的问题.用图所示装置进行实验,将A逐滴加入B中:
一个装置有多种用途是化学实验中经常出现的问题.用图所示装置进行实验,将A逐滴加入B中:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol?L-1 NaHCO3溶液中:c(CO3 2- )>c(H2CO3) |
| B、在0.1 mol?L-1 Na2CO3溶液中:c(OH- )=c(HCO3- )+c(H2CO3)+c(H+ ) |
| C、某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子,该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| D、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2 Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2 Fe(SO4)2]<c[(NH4)2 SO4]<c(NH4Cl) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com