
16.8g NaHCO3和7.8g Na2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃.最后容器内的物质是()
| A. | Na2CO3、Na2O2和O2 | B. | Na2CO3、O2和H2O(g) | |
| C. | Na2CO3、CO2、O2和H2O(g) | D. | NaHCO3、Na2CO3和O2 |
| 钠的重要化合物;化学方程式的有关计算. | |
| 专题: | 几种重要的金属及其化合物. |
| 分析: | 在密闭容器中充分加热,2NaHCO3Na2CO3+CO2↑+H2O,计所产生的气体CO2和H2O与Na2O2的反应为:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,最终可以看作生成的二氧化碳先与过氧化钠反应,然后水再与过氧化钠反应.计算16.8gNaHCO3分解生成的二氧化碳、水的质量,再根据二氧化碳与过氧化钠的反应进行过量计算判断是否有过氧化钠剩余,若过氧化钠剩余,则与水反应生成氢氧化钠,再根据剩余过氧化钠与水的量进行判断. |
| 解答: | 解:2NaHCO3 168 44 18 16.8 g 4.4g 1.8 g 2CO2+2Na2O2=2Na2CO3+O2, 88 156 4.4g 7.8g 7.8g Na2O2恰好与NaHCO3分解产生的4.4gCO2完全反应生成Na2CO3和O2.所以最后容器内的物质是Na2CO3、O2、H2O(g), 故选B. |
| 点评: | 本题考查钠重要化合物性质、混合物的有关计算,难度中等,注意过氧化钠与水、二氧化碳反应的性质,注意转化为二氧化碳、水与过氧化钠反应的先后问题进行的解答. |


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
元素的性质呈现周期性变化的根本原因是( )
A.原子半径呈周期性变化 B.元素的第一电离能呈现周期性变化
C.元素的电负性呈现周期性变化 D.元素原子的核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种同分异构体。A的结构简式如下:

(1)A的分子式是 。
(2)A中含氧官能团的名称是________________________。
(3)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是 。
(4)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是  。
。
(5)17.4克A与足量碳酸氢钠溶液反应,生成二氧化碳的体积 (标准状况)。
(6)A在浓硫酸作用下加热可与1molCH3CH2CH2OH发生反应,写出反应的化学方程式:
,其反应类型 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是 ( )
A c(A-)=c(K+) B c(H+)=c(OH-)<c(K+)<c(A-)
C V总≧20mL D V总≦20mL
查看答案和解析>>
科目:高中化学 来源: 题型:
在10mL0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为()
| A. | 0mL | B. | 0.672mL | C. | 1.34mL | D. | 2.240mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到a g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到b g沉淀,则下列说法正确的是()
| A. | 参加反应的CO2的体积为0.224a L | |
| B. | 用上述数据不能确定NaOH溶液的物质的量浓度 | |
| C. | 若a=b,则CO2与NaOH溶液反应的产物盐只有Na2CO3 | |
| D. | b可能等于a、小于a或大于a |
查看答案和解析>>
科目:高中化学 来源: 题型:
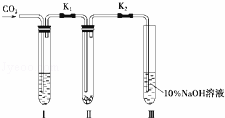
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:
实验甲:干燥的二氧化碳和过氧化钠的反应.在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2.在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化.
实验乙:潮湿的二氧化碳和过氧化钠的反应.在试管Ⅰ内装入试剂Y,其他操作同实验甲.观察到木条复燃,且Ⅱ中的淡黄色变为白色.
试回答下列问题:
(1)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是防止.
(2)在实验甲中,试剂X是浓硫酸;在实验乙中,试剂Y是.
(3)根据上述两个实验现象,得到的结论是.
(4)为了确保实验现象的准确性,制备CO2所用的反应物最好选用(填编号).
A.大理石B.小苏打C.烧碱D.盐酸E.稀硫酸F.稀硝酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,0.56 L CH4和C2H4的混合气体通入足量溴水中,溴水增重0.28g(假设C2H4完全被吸收),则乙烯占混合气体体积的( )
A.20% B.40% C.60% D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组测定菠菜中草酸及草酸盐含量(以C2O42-计),实验步骤如下:
①将菠菜样品预处理后,热水浸泡,过滤得到含有草酸及草酸盐的溶液。
②调节溶液的酸碱性,滴加足量的CaCO3溶液,产生白色沉淀;加入足量醋酸,使CaCO3溶解;过滤得到CaCO3固体。
③用稀HCl溶解CaC2O4 ,并加水配制成100mL溶液。每次准确移取25.00 mL该溶液,用0.0100mol·L-1KMnO4标准溶液滴定,平均消耗标准溶液VmL 。
回答下列问题:
⑴步骤①中“样品预处理”的方法是 。(A.灼烧成灰 B.研磨成汁)
⑵步骤②中“调节溶液的酸碱性”至 。(A.弱碱性 B.弱酸性 C.中性)
验证CaCl2溶液已“足量”的操作和现象是: 。
⑶步骤③中用到的玻璃仪器除烧杯、锥形瓶、胶头滴管、玻璃棒外,还有 。
⑷经计算,该菠菜样品中C2O42-的总物质的量为 ,若样品的质量为mg,则菠菜中草酸及草酸盐(以C2O42-计)的质量分数为 。
(已知: 2MnO4—+5C2O42-+16H-=2Mn2++10CO2 +8H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com