

分析 由图中转化可知,乙烯与溴发生加成反应生成A为BrCH2CH2Br,A发生水解反应生成乙二醇;乙烯与水发生加成反应生成乙醇,乙醇氧化生成B为CH3CHO,B氧化生成乙酸,乙二醇与乙酸发生酯化反应生成二乙酸乙二醇酯,以此来解答.
解答 解:(1)A的结构简式为BrCH2CH2Br,故答案为:BrCH2CH2Br;
(2)反应①④的反应类型分别为加成反应、取代或酯化反应,故答案为:加成反应;取代或酯化反应;
(3)反应②的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应④的化学方程式为2CH3COOH+HOCH2-CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2-CH2OOCCH3+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;2CH3COOH+HOCH2-CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2-CH2OOCCH3+2H2O.
点评 本题考查有机物的合成及推断,为高频考点,把握转化中的有机反应、官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
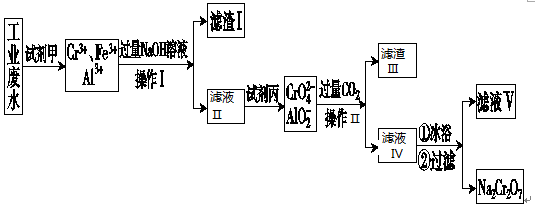
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冶炼金属时,必须加入一种物质作还原剂 | |
| B. | 利用金属活泼性的不同,可以采用不同的冶炼方法 | |
| C. | 湿法炼铜和火法炼铜的反应中,铜元素都发生还原反应 | |
| D. | 人类历史上大量生产和使用铝、铁、铜三种金属单质的时间顺序是铜、铁、铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质A的转化率为70% | |
| D. | 2 s 时物质B的浓度为1.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑦ | B. | ①⑦ | C. | ⑤⑥ | D. | ①⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S沸点比H2O高 | B. | NH3和CO2均属于弱电解质 | ||
| C. | NH3(l)气化为NH3(g)放出热量 | D. | HCOOH能与NH4HCO3反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和 KCl | B. | SiO2 和 CO2 | C. | CH4和 H2O | D. | KCl和 HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
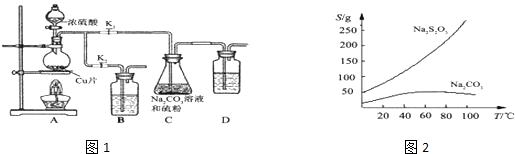
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com