
【题目】铁、铜的单质及它们的化合物与我们的生产、生活紧密相关。
(1)Cu处于周期表中______区,其最高能层的符号为______,基态铜原子的价电子排布式为________。
(2)向硫酸铜溶液中逐滴滴加氨水,首先形成蓝色沉淀,继续滴加氨水。沉淀溶解,得到深蓝色透明溶液,向深蓝色溶液中加入乙醇,析出深蓝色晶体。
①写出沉淀溶解,得到深蓝色透明溶液的离子方程式:________。
②为什么加入乙醇,能够析出深蓝色晶体?________________
③为什么NH3常在配合物中作配体,而NH4+却不能作配体?_______。
(3)Fe3+可以与SCN-、CN-、H2NCONH2(尿素)等多种配体形成很多的配合物。
①请写出一种与SCN-互为等电子体的分子:________。
②CN-的电子式为________。
③H2NCONH2(尿素)中N、C原子的杂化方式分别为_______、_______,组成尿素的4种元素的第一电离能由大到小的顺序为__________。
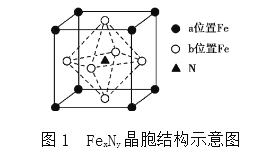
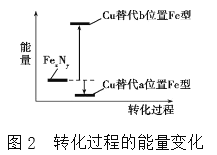
(4)某FeN,的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。
【答案】 ds N 3d104s1 Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 乙醇的极性小于水,在溶液中加入乙醇能够减小溶剂的极性,降低[Cu(NH3)4]SO4的溶解度 NH3中N原子能够提供孤电子对,而NH4+中N原子价电子层无孤电子对 CO2(或CS2、N2O、BeCl2) ![]() sp3 sp2 N>O>C>H Fe3CuN
sp3 sp2 N>O>C>H Fe3CuN
【解析】考查物质结构与性质的运用,(1)Cu的价电子排布式为3d104s1,位于第四周期IB族,属于ds区;最高能层符号为N;Cu属于副族元素,价电子包括最外层电子,以及次外层的d能级,即基态铜原子的价电子排布式为3d104s1;(2)①发生的反应是CuSO4+2NH3·H2O=Cu(OH)2↓+2NH4+,继续加入NH3·H2O,发生Cu(OH)2+4NH3=[Cu(NH3)4](OH)2,即深蓝色透明溶液为[Cu(NH3)4](OH)2,其离子方程式为 Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- ;②乙醇的极性小于水,在溶液中加入乙醇能够减小溶剂的极性,降低[Cu(NH3)4]SO4的溶解度;③形成配位键,一方提供孤电子对,一方提供空轨道,NH3中N原子能够提供孤电子对,而NH4+中N原子价电子层无孤电子对;(3)①根据等电子体的定义,与SCN-互为等电子体的分子是 CO2(或CS2、N2O、BeCl2);②CN-中C和N之间共用三键―即CN-的电子式为![]() ;③尿素的结构简式为
;③尿素的结构简式为 ,C的杂化类型为sp2,N的杂化类型为sp3;同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此第一电离能大小顺序是N>O>C>H;(4)能量越低,物质越稳定,即铜替代a位置Fe,即Cu的个数为8×1/8=1,Fe位于面心,个数为6×1/2=3,N位于体心,化学式为Fe3CuN。
,C的杂化类型为sp2,N的杂化类型为sp3;同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此第一电离能大小顺序是N>O>C>H;(4)能量越低,物质越稳定,即铜替代a位置Fe,即Cu的个数为8×1/8=1,Fe位于面心,个数为6×1/2=3,N位于体心,化学式为Fe3CuN。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
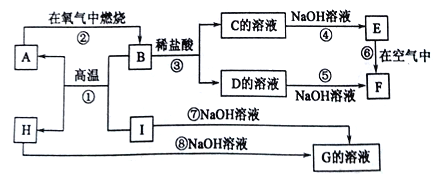
【题目】A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出)。已知H为两性氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均合同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是____________。
(2)写出C、H的化学式:C___,H______。
(3)写出反应①、⑦的化学方程式:反应①_______________,反应⑦________________。
(4)反应⑥过程中出现的现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
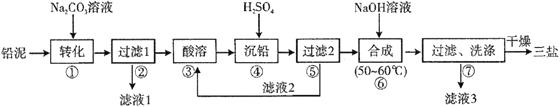
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;(2)铅与冷盐酸、冷硫酸几乎不起作用。请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________,该反应能发生的原因是__________________________。
(2)步骤②“过滤1”后所得滤渣的主要成分为__________________________。
(3)步骤③“酸溶”,最适合选用的酸为_________________,为提高酸溶速率,可采取的措施是___________________(任意写出一条)。
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1。
(5)从原子利用率的角度分析该流程的优点为_____________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为_____%(结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的工作原理及电池中发生的主要反应如图所示。下列说法错误的是
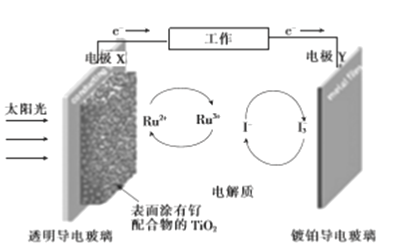
A. 电池工作时,光能转变为电能,X为电池的负极
B. 镀铂导电玻璃上发生氧化反应生成I-
C. 电解质溶液中发生反应:2Ru3++3I-![]() 2Ru2++I3-
2Ru2++I3-
D. 电池工作时,电解质溶液中I-和I3-的浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)常温下,0.1mol/L 的CH3COOH溶液中有1%的CH3COOH分子发生电离,则溶液的pH=;可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)V(醋酸)(填“>”、“<”或“=”)。
(3)0.1mol/L的某酸H2A的pH=4,则H2A的电离方程式为。
(4)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则NaOH溶液与盐酸溶液的体积比为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用二氧化锰和足量的浓盐酸反应中制备氯气,如果有34.8 g二氧化锰被还原,那么被氧化的HC1的物质的量是多少?得到的氯气的物质的量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是( )
A. 氢氧化钠溶液与二氧化硅反应:SiO2+2OH-=SiO32-+H2O
B. 常温时,0.1mol·L-1氨水的pH=11.1:NH3·H2O![]() NH4++OH-
NH4++OH-
C. 由Na和Cl形成离子键的过程: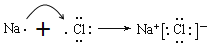
D. 大理石与醋酸反应CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种正盐的混合溶液中含有0.2molNa+ , 0.25molMg2+ , 0.4molCl﹣ , 则SO42﹣的物质的量为( )
A.0.1 mol
B.0.3 mol
C.0.5 mol
D.0.15 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com