
【题目】某稀溶液中含有3.5 mol KNO3和2.2 mol H2SO4,向其中加入1.2 mol Fe,充分反应(已知NO![]() 被还原为NO)。下列说法正确的是
被还原为NO)。下列说法正确的是
A.反应过程中转移的电子数3NA
B.反应后生成NO的体积为24.64 L
C.所得溶液中c(Fe2+)∶c(Fe3+)=1∶3
D.所得溶液中c(NO3-)=2.4 mol·L-1
【答案】C
【解析】
某稀溶液中含有3.5 mol KNO3和2.2 mol H2SO4,向其中加入1.2 mol Fe,充分反应(已知NO3-被还原为NO),先发生反应的离子方程式为
Fe + NO3- + 4H+ = Fe3+ + NO↑ + 2H2O
1.2mol 3.5mol 4.4mol
可见,氢离子消耗完,铁过量,消耗1.1 mol金属铁,1.1 mol NO3-,生成1.1 mol Fe3+,1.1 mol NO气体,铁还剩余0.1 mol,铁又和铁离子反应,Fe + 2Fe3+==3Fe2+,因此0.1 mol铁消耗0.2 mol Fe3+,生成0.3 mol Fe2+。
A选项,1.1 mol NO3-反应转移电子数3.3NA,故A错误;
B选项,无标准状况条件,无法计算反应生成的NO的体积,故B错误;
C选项,生成0.3 mol Fe2+,0.9 mol Fe3+,所得溶液中c(Fe2+)∶c(Fe3+)=1∶3,故C正确;
D选项,所得溶液中剩余n(NO3-)=2.4 mol,溶液体积未知,无法计算c(NO3-),故D错误;
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
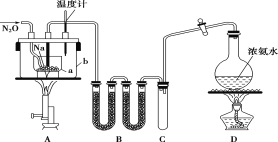
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为______。
(2)步骤①中先加热通氨气的目的是_______________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__________;步骤③中最适宜的加热方式为 ______(填“水浴加热”,“油浴加热”)。
(3)生成NaN3的化学方程式为 _______。
(4)图中仪器a用的是铁质而不用玻璃,其主要原因是_____。
(5)步骤④中用乙醚洗涤的主要目的是_______。
(6)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表代表周期表中的几种短周期元素,下列说法中错误的是

A. A、B、C第一电离能的大小顺序为C>B>A
B. C、D气态氢化物稳定性强弱和沸点高低均为C>D
C. AD3和ED4两分子的中心原子均为sp3杂化
D. ED4分子中各原子均达8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是
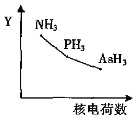
A. 相对分子质量B. 稳定性C. 沸点D. R-H键长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水。下列说法错误的是( )
A.步骤①后可依次用KSCN溶液和酸性KMnO4溶液来检测溶液中铁元素的价态
B.步骤②发生后,溶液的酸性增强
C.步骤③,将溶液蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥可得到绿矾
D.为确保铁黄的产率,尽可能将步骤④中的pH值调大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧乙烷(![]() )可用作一次性医用口罩的灭菌剂。通常可用以下两种方法制备:
)可用作一次性医用口罩的灭菌剂。通常可用以下两种方法制备:
① 氯代乙醇法:CH2=CH2+Cl2+Ca(OH)2→![]() +CaCl2+H2O
+CaCl2+H2O
② 银催化氧化法:2CH2=CH2+O2→2![]()
下列说法错误的是( )
A.方法① 和② 均为氧化还原反应
B.环氧乙烷分子中所有原子不可能处于同一平面
C.环氧乙烷用作灭菌剂是因为其强氧化性
D.方法② 的反应类型为加成反应,原子利用率100%且原料更环保
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com