
分析 (1)胶体粒子直径大小在1nm~100nm;
(2)溶液不产生丁达尔效应,而氢氧化铁胶体能产生丁达尔效应;
(3)搅拌能使胶体聚沉;
(4)氢氧化铁胶体先发生聚沉,然后盐酸溶液与氢氧化铁反应;
(5)血液可看作是胶体分散系,胶体遇电解质能发生聚沉.
解答 解:(1)氢氧化铁胶体是胶体分散系中的一种,胶体粒子直径大小在1nm~100nm,故答案为:1nm~100nm;
(2)胶体区别于溶液的关键在于:溶液粒子直径小于1nm,胶体粒子直径大小在1nm~100nm,即溶液不产生丁达尔效应,而氢氧化铁胶体能产生丁达尔效应,因此答案为:用一束光线照射,能产生一条光亮的通路,故答案为:用一束光线照射,能产生一条光亮的通路(也可利用胶体的其他性质进行检验,但要注意表达规范);
(3)搅拌能使胶体聚沉,原因是搅拌能减弱胶粒对电荷的吸附能力,使胶粒容易碰撞结合成更大的颗粒而聚沉,故边滴加溶液边用玻璃棒搅拌,会导致制备胶体失败,故答案为:搅拌使胶体发生聚沉而出现浑浊;
(4)向Fe(OH)3胶体中逐滴加入过量的稀盐酸,先胶体和电解质溶液产生聚沉现象,有沉淀生成;后氢氧化铁又和盐酸反应生成可溶性的氯化铁,所以沉淀又溶解,故答案为:先出现浑浊后浑浊逐渐消失;
(5)血液属于胶体,加入电解质溶液(FeCl3溶液)可使胶粒聚沉,血液凝聚达到止血效果,故答案为:b.
点评 本题要求熟练掌握胶体的制备知识,题目难度不大,特别是氢氧化铁胶体的制备方程式是常考常错的内容,胶体的聚沉以及沉淀的溶解一直是具有一定综合性的热点.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| 实 验 操 作 | 现 象 | 实 验 结 论 | |
| A | 向某溶液中加入硝酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有SO42- |
| B | 将某溶液蘸取少量放置于火焰上灼烧 | 火焰呈黄色 | 该溶液中一定含K+ |
| C | 往某溶液中加入KSCN溶液 | 显血红色 | 溶液中一定含有Fe3+ |
| D | 往某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
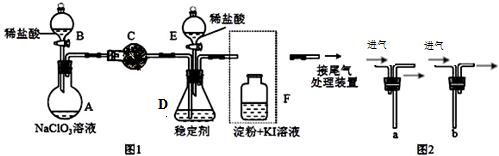

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,Y是地壳中含量最多的元素,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,Y是地壳中含量最多的元素,下列说法中正确的是( )| A. | 非金属性:X>Y | |
| B. | 原子半径:Z>W>X>Y | |
| C. | 氢化物的沸点:Z>Y | |
| D. | W的单质能水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧的铁丝在氯气中燃烧,集气瓶内充满棕黄色烟雾 | |
| B. | 氢气在氯气中燃烧,集气瓶口有白雾 | |
| C. | 向盛水的烧杯中先加入过氧化钠,再滴加酚酞,最终溶液呈红色 | |
| D. | 将一块钠放在燃烧匙中加热,燃烧后得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
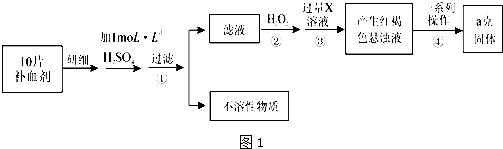
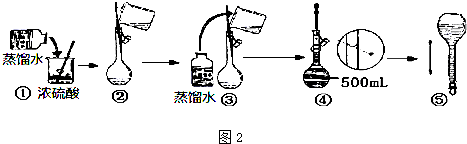
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温有利于提高反应的转化率 | |
| B. | 高温可增大反应的限度 | |
| C. | 700K时反应催化剂活性最强,反应速率更快 | |
| D. | 高温才可以自发向右进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

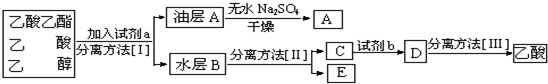
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com