
下列关于有机化合物的说法正确的是
A.苯在常温下可与溴水发生取代反应
B.糖类、油脂和蛋白质都能发生水解反应
C.乙醇和乙酸都能与金属钠反应
D.葡萄糖能发生氧化反应和银镜反应
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
有机物A广泛用于涂料、油墨、胶黏剂、医药及农药中间体领域。
已知:有机物A的仪器分析如下:
|
|
|
|
| ③ 有机物A的核磁共振氢谱图上有2个吸收峰,峰面积之比是1︰1。 |
回答下列问题:
(1)A的相对分子质量是 ;
(2)A含有官能团的名称是___________;
(3)A与氢氧化钠溶液在加热条件下反应的化学方程式是
;
(4)A有多种同分异构体,其中能与新制Cu(OH)2共热,产生红色沉淀的有 种,
写出其中任意一种同分异构体的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
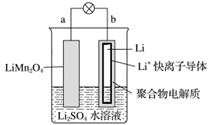
A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
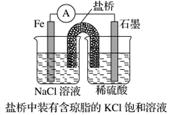
①某原电池装置如图所示,上图右侧烧杯中的电极反应式为____________,左侧烧杯中的c(Cl-)____________(填“增大”、“减小”或“不变”)。
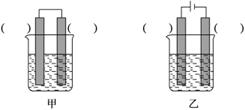
②已知下图甲、乙两池的总反应式均为Fe+H2SO4===FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“C”)。
(2)用高铁(Ⅵ)酸盐设计的高铁(Ⅵ)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极反应式:____________________________________________________。
②用高铁(Ⅵ)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2 mol K2FeO4反应时,则在电解池中生成H2________ L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A.用白醋除铁锈:Fe2O3+6H+==3H2O+2Fe3+
B.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:
Ba2++ 2OH-+NH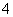 + HCO
+ HCO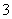
 NH3↑+2H2O+BaCO3↓
NH3↑+2H2O+BaCO3↓
C.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3˙H2O == AlO2-+4NH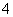 +2H2O
+2H2O
D.MnO2与浓盐酸反应制取Cl2:MnO2+4H++4Cl-== Mn2++2Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0 kJ·mol-1
C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1
则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H= kJ·mol-1。
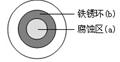 (2)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色 (b),如右图所示。液滴中心是 区(填“正极”或“负极”),其电极反应式为 。为减缓钢铁的腐蚀,可与锌块相连,该方法称为 。
(2)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色 (b),如右图所示。液滴中心是 区(填“正极”或“负极”),其电极反应式为 。为减缓钢铁的腐蚀,可与锌块相连,该方法称为 。
(3)铁钛合金是一种不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O= TiO2+(无色)+Fe2++2H+
③ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)基态Cu2+的核外电子排布式为 。
(2)根据价层电子对互斥模型(VSEPR),PO43-离子内中心原子价层成键电子对和孤电子对之和为 ,离子的空间构型是 。
(3)液氨分子间存在自耦电离:2NH3 NH2-+NH4+,NH2-中氮原子轨道的杂化类型是 ,H+易与NH3形成NH4+,配位键的解释是 。
NH2-+NH4+,NH2-中氮原子轨道的杂化类型是 ,H+易与NH3形成NH4+,配位键的解释是 。
(4)胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有 。(填序号)
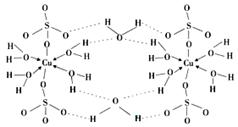
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,Cu2+的配位数为 ,1mol CN-中含有的π键的数目为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关粒子半径的叙述正确的是
A、电子层结构相同的粒子随核电荷的递增半径逐渐增大
B、CsCl、NaBr、CaF2、LiI四种化合物中LiI的阴阳离子半径之比值最大
C、S2-半径小于硫原子半径
D、无法比较K+、Al3+ 、O2- 、Cl-的半径大小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com