
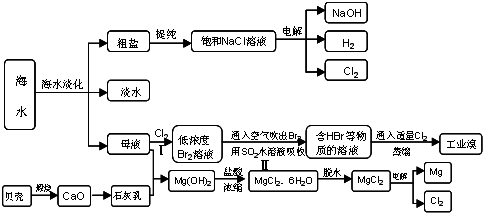
海水占地球总储水量的97.2%,若把海水淡化和加工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度的淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐+H2O―→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是________;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐________t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:

请写出②④的化学反应方程式:
________________________________________________________________________
________________________________________________________________________。
(5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为HOCH2SO3Na,根据其结构特点,“吊白块”不能发生的反应有________(填字母)。
A.皂化反应 B.聚合反应
C.与金属钠反应 D.氧化反应
(1)ⅠA (2)物理变化 (3)NaCl 585
(4)NaOH+SO2===NaHSO3,NaHSO3+HCl===NaCl+H2O+SO2↑ (5)AB
【解析】
试题分析:(1)钠的原子序数是11,位于周期表的第IA族第三周期
(2)蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,所以蒸馏是物理变化。
(3)根据反应的化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑,H2+Cl2
2NaOH+H2↑+Cl2↑,H2+Cl2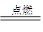 2HCl可知
2HCl可知
由n(HCl)= =10×106 mol
=10×106 mol
则m(NaCl)=10×106 mol×58.5 g·mol-1=585×106 g=585 t。
(4)SO2是酸性氧化物能和氢氧化钠反应生成亚硫酸氢钠,亚硫酸氢钠又能和酸反应重新生成SO2,反应的化学方程式是NaOH+SO2===NaHSO3,NaHSO3+HCl===NaCl+H2O+SO2↑。
(5)亚硫酸氢钠与甲醛的反应实质上是加成反应:HCHO+NaHSO3―→HOCH2SO3Na,由结构简式可看出有醇羟基,故能发生与金属钠的反应及氧化反应,这就是醇的典型反应,答案选AB。
考点:考查周期表的结构、蒸馏原理电解饱和食盐水的计算、方程式的书写以及有机物结构和性质的判断等
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,考查的知识点多,但都很基础。该题有利于培养学生的逻辑推理能力以及灵活运用基础知识解决实际问题的能力,也有利于培养学生的知识迁移能力。


科目:高中化学 来源: 题型:


| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com