
【题目】雷诺嗪是治疗慢性心绞痛首选新药。雷诺嗪合成路线如下:

(1)雷诺嗪中含氧官能团,除酰胺键(-NHCO-)外,另两种官能团名称:___、____。
(2)写出满足下列条件A的同分异构体的数目_____。①能与FeCl3溶液发生显色反应;②1mol该分子可与2molNaOH反应。
(3)从雷诺嗪合成路线得到启示,可用间二甲苯、ClCH2COCl、(C2H5)NH(无机试剂任用)合成盐酸利多卡因,请在横线上补充反应物,在方框内补充生成物。_____、_____、_____、_____、_____、_____。

盐酸利多卡因
已知:![]()

【答案】羟基 醚键 6 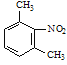 Fe/HCl
Fe/HCl 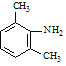 ClCH2COCl
ClCH2COCl 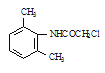 (C2H5)2NH
(C2H5)2NH
【解析】
(1)根据雷诺嗪的结构判断含有的官能团;(2)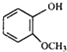 的同分异构体中,能与FeCl3溶液发生显色反应,说明含有酚羟基-OH,1mol可与2molNaOH反应、分子中含有2个酚羟基,故还含有1个-CH3,定2个酚羟基位置,移动-CH3,确定同分异构体数目;(3)由
的同分异构体中,能与FeCl3溶液发生显色反应,说明含有酚羟基-OH,1mol可与2molNaOH反应、分子中含有2个酚羟基,故还含有1个-CH3,定2个酚羟基位置,移动-CH3,确定同分异构体数目;(3)由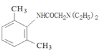 逆推,间二甲苯发生硝化反应生成
逆推,间二甲苯发生硝化反应生成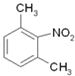 ,在Fe/HCl作用下还原生成
,在Fe/HCl作用下还原生成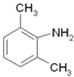 ,再与ClCH2COCl发生取代反应生成
,再与ClCH2COCl发生取代反应生成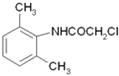 ,与(C2H5)2NH发生取代反应生成
,与(C2H5)2NH发生取代反应生成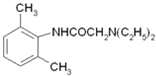 ,用HCl酸化可得盐酸利多卡因。
,用HCl酸化可得盐酸利多卡因。
(1)由雷诺嗪的结构图可知,雷诺嗪中含氧官能团,除酰胺键(-NHCO-)外,另两种官能团为羟基、醚键;(2) 的同分异构体中,能与FeCl3溶液发生显色反应,含有酚羟基-OH,1mol可与2molNaOH反应、分子中含有2个酚羟基,故还含有1个-CH3,若2个-OH相邻,-CH3有2种位置,若2个-OH相间,-CH3有3种位置,若2个-OH对,-CH3有1种位置,故符合条件的同分异构体有2+3+1=6种;(3)由
的同分异构体中,能与FeCl3溶液发生显色反应,含有酚羟基-OH,1mol可与2molNaOH反应、分子中含有2个酚羟基,故还含有1个-CH3,若2个-OH相邻,-CH3有2种位置,若2个-OH相间,-CH3有3种位置,若2个-OH对,-CH3有1种位置,故符合条件的同分异构体有2+3+1=6种;(3)由 逆推,间二甲苯发生硝化反应生成
逆推,间二甲苯发生硝化反应生成 ,在Fe/HCl作用下还原生成
,在Fe/HCl作用下还原生成 ,再与ClCH2COCl发生取代反应生成
,再与ClCH2COCl发生取代反应生成 ,与(C2H5)2NH发生取代反应生成
,与(C2H5)2NH发生取代反应生成 ,用HCl酸化可得盐酸利多卡因。盐酸利多卡因的合成路线图为:
,用HCl酸化可得盐酸利多卡因。盐酸利多卡因的合成路线图为: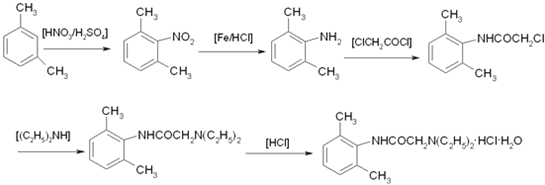


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g) ![]() CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则

(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | C1 | C2 | C3 | C3 |
4 | C1 | C2 | C3 | C3 |
5 | 0.116 | 0.216 | 0.084 | C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 .增大了CO2浓度 d.增加了氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se是迄今为止发现的最重要的抗衰老元素,也有抗癌之王的美誉。回答下列问题:
(1)基态Se原子核外电子占据的轨道中,电子云轮廓图形状为哑铃形的有 _____个;第四周期的过渡金属中,基态原子核外未成对电子数与基态Se原子相同的有____种。
(2)Se及其同周期相邻元素相比,三种元素的基态原子的第一电离能由大到小的顺序为____。
(3) H2Se属于____(填“极性”或“非极性”)分子;其熔点低于同条件下NaH熔点的原因为______。
(4) SeO2的立体构型为____。SeO3中Se原子的杂化形式为____。
(5)写出一种与SeO42-互为等电子体的分子式____.
(6)Se能与 形成具有多种生物活性的配合物。1mol
形成具有多种生物活性的配合物。1mol 中含有σ键的数目为 ___。
中含有σ键的数目为 ___。
(7)硒化锌是一种重要的半导体材料,其立方晶胞结构如图所示。若晶胞参数为apm,阿伏加德罗常数的值为NA晶体密度为ρ g·cm-3,则硒化锌的摩尔质量可表示为 ___。(列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构式(键线式)及球棍模型如下,该有机分子的1H核磁共振谱图如下(单位是ppm)。下列关于该有机物的叙述正确的是

A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香族化合物
C. 键线式中的Et代表的基团为—CH3
D. 该有机物在一定条件下能够发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液和FeCl36H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl36H2O。下列有关实验说法正确的是( )
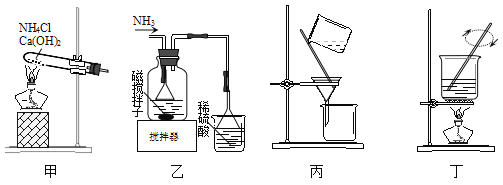
A. 用H2O2氧化废蚀刻液的离子方程式为:2H++2Fe2++H2O2=2Fe3++2H2O
B. 用装置甲可以制备Cu(NH3)4Cl2并沉铁
C. 用装置乙可以分离Cu(NH3)4Cl2溶液和Fe(OH)3
D. 用装置丁由FeCl3溶液制备FeCl36H2O需要经蒸发浓缩、冷却结晶、过滤洗涤等步骤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图:A处通入氯气。关闭B阀时,C处干燥红色布条无变化;打开B阀时,C处干燥红色布条褪色。则D中盛放的试剂不可能的是

A.饱和食盐水B.浓硫酸
C.溴化钠溶液D.氢氧化钙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3(红褐色固体)。

(1)Fe(OH)3中铁元素化合价为______,该脱氧反应中还原剂是_________。
(2)某化学兴趣小组用食品脱氧剂(2g铁粉、0.5g活性炭、0.5g氯化钠)进行如下两个实验。
实验Ⅰ: 请回答:
①操作Ⅰ的名称是________,溶液丙中一定含有的金属阳离子是__________(写离子符号);
实验Ⅱ:将乙烘干后进行如下实验,物质之间的转化关系如下图(部分产物略去)。

②写出反应②的离子方程式,并用双线桥法表示电子转移的方向和数目_________;
③向溶液C中加入BaCl2溶液,有白色沉淀产生,其离子方程式为____________;反应③的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学准备用CuSO4·5H2O配制490 mL 0.1 mol/L的溶液。
(1)小王同学选用的玻璃仪器有:烧杯,玻璃棒,胶头滴管,___。
(2)玻璃棒在该实验中有重要的用途,分别是___和____;
(3)小王同学通过计算,用托盘天平称取___g CuSO4·5H2O。
(4)物质的量浓度误差(填偏高、偏低、无影响)
A.若容量瓶洗净后未干燥,其中残留少量水,则所配制的溶液浓度将_____;
B.定容时,若眼睛俯视,则所配制的溶液浓度将_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com