
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4 ![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据________________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理__________________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理________________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

请回答:
(1)A的组成元素为_____________(用元素符号表示),化学式为__________。
(2)溶液C可溶解铜片,例举该反应的一个实际应用________________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为________。写出该反应的离子方程式______________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
【答案】
Ⅰ.(1)反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气。
(2)Al2O3+2OH—=2AlO2+H2O
(3)NH4Cl+H2O![]() NH3·H2O+HCl,MgO+2HCl=MgCl2+H2O
NH3·H2O+HCl,MgO+2HCl=MgCl2+H2O
Ⅱ.(1)S、FeFe3S4(2)制印刷电路板
(3)![]() ;Fe3S4+6H+=3H2S↑+3Fe2++S
;Fe3S4+6H+=3H2S↑+3Fe2++S
(4)H2SO3+I2+H2O=H2SO4+2HI;取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42,过滤后取滤液,滴加H2O2溶液,若产生白色沉淀,则有H2SO3。
【解析】
试题分析:Ⅰ.(1)2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3 ,分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会阻止燃烧,水蒸气稀释空气,故答案为:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气;
27H2O↑+10MgO+3Al2O3 ,分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会阻止燃烧,水蒸气稀释空气,故答案为:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气;
(2)氧化镁是碱性氧化物溶于酸,氧化铝是两性氧化物溶于酸、碱溶于,加入氢氧化钠溶于溶解后过滤除去,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)氯化铵溶液中铵根离子水解溶液显酸性,氧化镁溶于水解生成的酸,反应的化学方程式为:MgO+2NH4Cl+H2O=MgCl2+2NH3H2O,故答案为:MgO+2NH4Cl+H2O=MgCl2+2NH3H2O;
Ⅱ.C加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,可知B为Fe2O3,且n(Fe2O3)=![]() =0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=
=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=![]() =0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4。
=0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4。
(1)由以上分析可知,A组成元素为Fe、S,为Fe3S4,故答案为:Fe、S;Fe3S4;
(2)铁离子具有强氧化性,可氧化铜,常用于刻饰铜线路板,故答案为:刻饰铜线路板;
(3)化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518gL-1),淡黄色不溶物为S,气体的相对分子质量为1.518×22.4L=34,为H2S气体,电子式为![]() ,反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑,故答案为:
,反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑,故答案为:![]() ;Fe3S4+6H+=3Fe2++S+3H2S↑;
;Fe3S4+6H+=3Fe2++S+3H2S↑;
(4)F→G反应的化学方程式为H2SO3+I2+H2O=H2SO4+2HI,溶液G中的主要微粒(不考虑H2O,H+,K+,I-) 为SO42-和H2SO3,可先检验SO42-,后检验有H2SO3,具体操作为:取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;过滤后取滤液,滴加H2O2溶液,若再产生白色沉淀,则有H2SO3.故答案为:H2SO3+I2+H2O=H2SO4+2HI;取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;过滤后取滤液,滴加H2O2溶液,若再产生白色沉淀,则有H2SO3。


科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是

A.反应的化学方程式为:2 M![]() N
N
B.t1时,N的浓度是M浓度的2倍
C.t2时,正逆反应速率相等,达到平衡
D.t3时,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列有关实验装置,相关评价错误的是( )
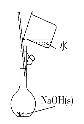
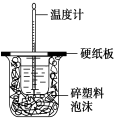

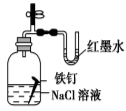
图(1) 图(2) 图(3) 图(4)
A.图(1)用于配制0.10 mol·L-1 NaOH溶液;评价:正确
B.图(2)用于测定中和热;评价:错误,装置中缺少了环形玻璃搅拌棒
C.图(3)用于比较Na2CO3、NaHCO3的热稳定性;评价:正确
D.图(4)证明铁发生吸氧腐蚀时空气参加反应;评价:正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行的相应实验,不能达到实验目的是( )
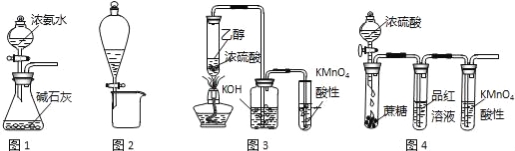
A.图1装置可制取氨气
B.图2装置可分离CH3COONa和CH3COOC2H5混合液
C.图3所示装置可制取乙烯并验证其易被氧化
D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于几类化合物的表述,不正确的是
A.DNA既是原核生物的遗传物质,也是真核生物的遗传物质
B.蛋白质、糖类、脂肪,核酸都能为细胞的生命活动提供能量
C.胆固醇是构成动物细胞膜的重要成分,在人体内还参与血液中脂质的运输
D.性激素能激发并维持动物的笫二性征,其化学本质为脂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】心脏起搏器一般是给心跳缓慢的病人使用。某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2=4LiCl+S+SO2,已知SOCl2结构式为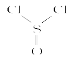 ,下列有关判断正确的是( )
,下列有关判断正确的是( )
A.还原剂只有锂
B.氧化产物包括LiCl和SO2
C.SOCl2中既有离子键,也有共价键
D.晶格能:LiCl<NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,但对维持生物体正常生命活动必不可少的元素有
A.Fe、Mn、Zn、Mg B.Zn、Cu、P、Ca
C.Zn、Cu、B、Mn D.K、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如图所示的转化
关系是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
C | Fe2O3 | FeCl3 | Fe(OH)3 | ④加入盐酸 |
D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com