
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | M与T形成的化合物熔沸点高 | |
| B. | 最高价氧化物对应的水化物碱性:L<Q | |
| C. | 氢化物的还原性:H2 R<H2 T | |
| D. | 离子半径:T2-<L2+ |
分析 短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,可知R为S元素,L、M、Q只有正价,原子半径L>Q,则L为Mg元素,Q为Be元素,原子半径M的介于L、R之间,则M为Al元素.
A、M与T形成的化合物为氧化铝;
B、同主族从上到下金属性增强,其最高价氧化物对应的水化物碱性增强;
C、非金属性越强,氢化物的还原性越弱;
D、电子排布式相同的离子,原子序数越大,离子半径越小.
解答 解:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,可知R为S元素,L、M、Q只有正价,原子半径L>Q,则L为Mg元素,Q为Be元素,原子半径M的介于L、R之间,则M为Al元素.
A、M与T形成的化合物为氧化铝,氧化铝的熔沸点很高,故A正确;
B、同主族从上到下金属性增强,其最高价氧化物对应的水化物碱性增强,金属性:Be<Mg,则最高价氧化物对应的水化物碱性:L>Q,故B错误;
C、非金属性越强,氢化物的还原性越弱,非金属性:S<O,则氢化物的还原性:H2R>H2T,故C错误;
D、电子排布式相同的离子,原子序数越大,离子半径越小,则离子半径:T2->L2+,故D错误.
故选A.
点评 本题考查元素的性质,学生能利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质来解答即可,难度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:解答题
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 | 366 | 298 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol | B. | 1.1mol | C. | 1.8 mol | D. | 1.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据所学知识回答下列问题,在如图所示装置中
根据所学知识回答下列问题,在如图所示装置中查看答案和解析>>
科目:高中化学 来源: 题型:填空题
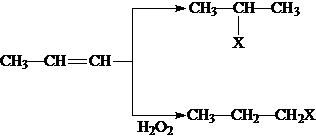 (X为溴原子)
(X为溴原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.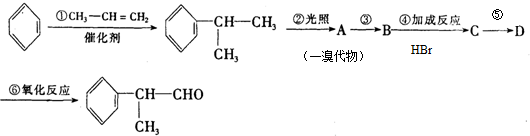
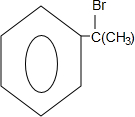
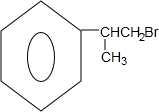 .
. 、
、 、
、 任意1种.
任意1种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ④⑥ | C. | ①④⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
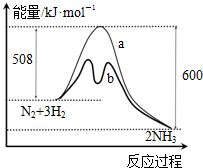
| A. | 升高温度可增大正反应速率,降低逆反应速率 | |
| B. | 正反应的活化能大于逆反应的活化能 | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com