
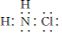 .
.分析 (1)根据化合价的代数和为0计算;NH2Cl是共价化合物,N、Cl原子周围8个电子;
(2)NH2Cl水解生成一水合氨和HClO;
(3)NCl3中Cl元素的化合价为+1价,反应生成Cl为-1价,结合物质的量计算;
(4)己知:①2NH3(g)+3C12(g)=N2(g)+6HCl(g)△H1=-469kJ/mol
②N2(g)+3C12(g)=2NC13(g)△H2=+520kJ/mol,根据盖斯定律,$\frac{1}{2}$(①+②)得到NH3(g)+3C12(g)=NC13(g)+3HCl(g)据此计算.
解答 解:(1)NH2Cl中N元素为-3价,H为+1价,则氯元素的化合价为+1价;NH2Cl是共价化合物,N、Cl原子周围8个电子,则其电子式为: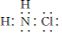 ;
;
故答案为:+1;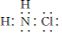 ;
;
(2)NH2Cl水解生成一水合氨和HClO,水解方程式为NH2Cl+2H2O?NH3•H2O+HClO;
故答案为:NH2Cl+2H2O?NH3•H2O+HClO;
(3)NCl3中Cl元素的化合价为+1价,反应生成Cl为-1价,0.01mol NCl3转移电子为0.06mol,100mL0.5mol/LNa2SO3溶液中Na2SO3为0.05mol,Na2SO3作还原剂能失去0.1mol电子,所以Na2SO3过量,按照NCl3计算转移电子为0.06mol;
故答案为:0.06mol;
(4)己知:①2NH3(g)+3C12(g)=N2(g)+6HCl(g)△H1=-469kJ/mol,
②N2(g)+3C12(g)=2NC13(g)△H2=+520kJ/mol,
根据盖斯定律,$\frac{1}{2}$(①+②)得到NH3(g)+3C12(g)=NC13(g)+3HCl(g),则△H3=$\frac{1}{2}$(-469kJ/mol++520kJ/mol)=+25.5kJ/mol;
故答案为:+25.5.
点评 本题考查氧化还原反应、盖斯定律的计算,为高频考点,把握反应中元素的化合价变化以及盖斯定律的内容为解答的关键,注意从化合价角度分析氧化还原反应,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
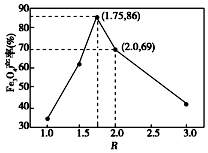
| 沉淀物 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀物PH | 3.0 | 8.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2为0.8mol/L,O2为0.4 mol/L | B. | SO2为0.5 mol/L | ||
| C. | SO3为0.8 mol/L | D. | SO2、SO3均为0.3 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸纤维属于酯类 | |
| B. | 顺-2-丁烯与反-2-丁烯的沸点不同 | |
| C. | 脱氧核糖核酸(DNA)是高分子有机物 | |
| D. | 由苯酚与溴水的反应可知,苯环影响了羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O?H3O++OH- | B. | H2S?H++HS- | C. | NaHS=Na++HS- | D. | HCO3-=H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 25℃、1.01×105 Pa下,44g CO2中含有的原子数为3NA | |
| C. | 1 L 0.5mol/L Na2CO3 溶液中含有的CO32-数目为0.5NA | |
| D. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
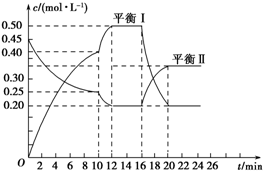 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在5min内该反应用C的浓度变化表示的反应速率为0.2mol/(L•min) | |
| B. | 5min时,容器内D的浓度为0.2mol/L | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5min时容器内气体总的物质的量为3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com