
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
 (5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
(5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。(1)四;ⅣB(各1分)
(2)2FeTiO3+6C+7Cl2=2 FeCl3+2TiCl4+6CO(3分)
(3)TiCl4+(2+x)H2O TiO2·xH2O↓+4HCl,加入大量水并加热,促使水解趋于完全;(3分)
TiO2·xH2O↓+4HCl,加入大量水并加热,促使水解趋于完全;(3分)
(4)防止钛 、镁被氧化(或防止钛镁与空气、水反应),1412(各1分)
(5)①向逆反应方向进行②5(各2分)
解析试题分析:(1)Ti的原子序数为22,根据核外电子排布规律得Ti位于元素周期表中第四周期,第ⅣB元素;
(2)结合流程图,钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式为2FeTiO3+6C+7Cl2=2 FeCl3+2TiCl4+6CO
(3)TiCl4水解生成TiO2·xH2O化学方程式为TiCl4+(2+x)H2O TiO2·xH2O↓+4HCl,产物氯化氢易挥发,加入水并加热,氯化氢浓度减小,平衡一直正向进行,水解趋于完全;
TiO2·xH2O↓+4HCl,产物氯化氢易挥发,加入水并加热,氯化氢浓度减小,平衡一直正向进行,水解趋于完全;
(4)钛、镁易与空气中的氧气反应,得不到钛单质;反应后得到Mg、MgCl2、Ti的混合物,Mg、MgCl2的沸点都比钛的沸点低,所以温度只要略高于1412℃即可把Mg、MgCl2除去;
(5)该温度下CO、H2、CH3OH的浓度分别为1 mol/L、1.5 mol/L、1mol/L,其浓度商大于0.27,所以反应逆向进行;上述产业链中FeTiO3~7Cl2~6CO~6CH3OH,电解饱和食盐水得7Cl2~7H2,所以产链中6CH3OH~7H2,而由CO和H2合成甲醇反应中6CH3OH~12H2,所以生成6 mol甲醇,至少需额外补充H25mol。
考点:考查核外电子排布,化学方程式的书写,化学平衡理论的应用,电解原理的应用,分析计算能力


科目:高中化学 来源: 题型:填空题
(14分)工业上以乙苯为原料生产苯乙烯的反应如下(Ph代表苯基):
Ph—CH2CH3(g) Ph—CH=CH2(g)+H2(g) △H
Ph—CH=CH2(g)+H2(g) △H
某研究小组为探究温度等因素对该反应的产率影响,在容积可变的密闭容器中分别作了四组实验,实验结果如下图a、b所示。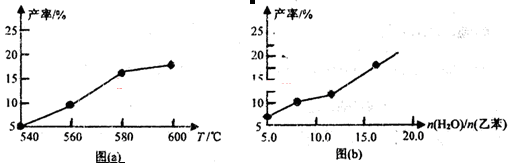
(1)根据反应及上图(a),判断△H 0(填“<”“=”或“>”,下同),△S 0;请选择经济、且适宜的反应温度: 。
(2)下列事实可以说明该反应已达平衡的是 。
A.混合气体的密度不再变化
B.氢气的体积分数保持不变
C.氢气、苯乙烯的生成速率之比保持不变
D.单位时间内消耗的n(乙苯)等于生成的n(H2)
(3)从压强因素分析,为提高乙苯的转化率,应采用 的生产条件。实际工业生产中常采用通入水蒸气的方法。水蒸气的含量对反应的影响结果如上图(b)所示。
①在做这四组实验时,应该采用的其他实验条件是 。
A.反应温度相同 B.采用不同的催化剂
C.压强都控制在常压下 D.反应相同时间时测定实验数据
②图(b)表明: 。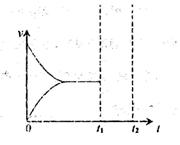
③一定温度下,在恒压密闭容器中,通入一定量n(H2O)/n(乙苯)=7:1的气体,发生上述反应,在t1时刻达到平衡。保持其他条件不变,此时分离出一定量的水蒸气,在t2时刻重新达到平衡,请在右图中画如反应再次达到平衡过程的图像。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
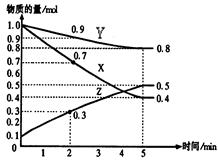
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如下图所示。
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至2min时Z的平均反应速率为 ;
(3)下列关于化学反应速率与化学反应限度的叙述不正确的是 ( )
| A.反应限度是一种平衡状态,此时反应已经停止 |
| B.达到平衡状态时,正反应速率和逆反应速率相等 |
| C.达到平衡状态时,反应物和生成物浓度都不再改变 |
| D.化学反应速率理论是研究怎样在一定时间内快出产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨工业中,原料气(N2、H2及少量的CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气中的CO,其反应是:[Cu(NH3)2CH3COO]+CO+NH3 [Cu(NH3)3]CH3COO·CO(正反应为放热反应)
[Cu(NH3)3]CH3COO·CO(正反应为放热反应)
(1)必须除去原料气中的CO的原因是 。
(2)醋酸二氨合铜(Ⅰ)溶液吸收CO的生产适宜条件是 。
(3)吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用,醋酸铜氨溶液再生的适宜条件是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 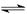 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K= 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
| A.v正(H2O)=v逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗n mol H2的同时消耗n mol CO |
| D.容器中物质的总物质的量不随时间改变 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如下图所示。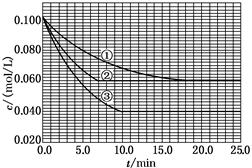
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②______________________________________________;
③______________________________________________;
(2)实验②平衡时B的转化率为________;实验③平衡时C的浓度为________________;
(3)该反应的ΔH________0,其判断理由是_________________________________;
(4)该反应进行到4.0 min时的平均反应速率:
实验②:vB=________;
实验③:vC=________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。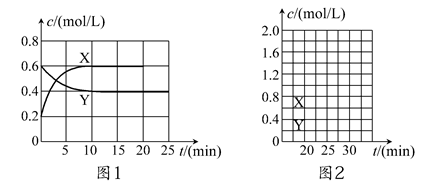
请回答:
(1)图l中,曲线________(填“X”或“Y”)表示NO2浓度随时间的变化情况;前10 min内v(NO2)=________mol/(L·min)。
(2)下列选项中不能说明该反应已达到平衡状态的是________(填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com