
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
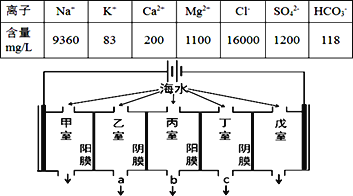
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为b
D. 淡化过程中易在戊室形成水垢
【答案】B
【解析】
A、Cl-放电能力大于OH-;
B、戊室收集到22.4L即1molH2,转移电子2mol,通过甲室阳膜的阳离子有Na+、K+、Ca2+、Mg2+等;
C、阴(阳)离子交换膜只允许阴(阳)离子通过,电解时丙室中阴离子移向乙室,阳离子移向丁室,所以丙室中物质主要是水;
D、开始电解时,甲室为阳极,氯离子放电生成氯气,戊室为阴极,水得电子生成氢气同时生成OH-,生成的OH-和HCO3-反应生成CO32-,Ca2+转化为CaCO3沉淀。
A、Cl放电能力大于OH,所以阳极的电极反应式为2Cl2e=Cl2↑,故A不选;
B、戊室收集到22.4L即1molH2,转移电子2mol,而通过甲室阳膜的阳离子有Na+、K+、Ca2+、Mg2+等,所以通过甲室阳膜的离子的物质的量一定小于为2mol,故B选;
C、阴(阳)离子交换膜只允许阴(阳)离子通过,所以电解时丙室中阴离子移向乙室,阳离子移向丁室,所以乙室和丁室中部分离子的浓度增大,丙室中物质主要是水,淡水的出口应为b,故C不选;
D、开始电解时,阳极上氯离子放电生成氯气,阴极上水得电子生成氢气同时生成OH,生成的OH和HCO3反应生成CO32,Ca2+转化为CaCO3沉淀,所以电解一段时间后阴极区会发生反应:Ca2++OH+HCO3=CaCO3↓+H2O,故D不选。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素。其中X是形成化合物种类最多的元素,Y原子基态时2p原子轨道上有3个未成对的电子,Z单质占空气体积的![]() ,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的电负性从大到小的顺序是___ (用元素符号表示,下同),三种元素的第一电离能由大到小的顺序为______。
(2)写出X的电子排布式_____。
(3)W同周期的元素中,与W原子最外层电子数相等的元素还有_____。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是____(用化学式表示),原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物甲的分子式为C3H7Br,在适宜的条件下能发生如下转化关系:
B![]() A
A![]() 甲(C3H7Br)
甲(C3H7Br)![]() D
D![]() E
E
已知:B能发生银镜反应,试回答下列问题:
(1)甲的结构简式:____________________。
(2)B与银氨溶液反应的化学方程式:____________________________。
(3)甲与NaOH醇溶液共热的化学方程式为:____________________________________。
(4)A与氧气反应生成B的化学方程式:_______________________________________。
(5)D生成E的化学方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是( )
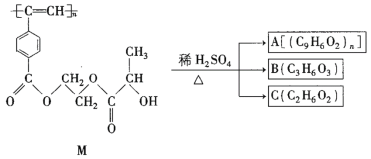
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2
D. 1molM与热的烧碱溶液反应,可消耗2nmolNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属在人类生产生活中得到了广泛应用,请你回答下列问题。
(1)面包发酵粉的主要成分之一是一种钠盐,其俗称为________;漂白粉的有效成分为__________(写化学式);FeCl3常用作净水剂,其原理为_________(用离子方程式表示)。
(2)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是_________。
(3)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(4)某CuSO4、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液中阳离子的浓度为___________mol/L,若向此溶液中加入金属Zn,则最多溶解Zn的质量为____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl26H2O的流程如图:

(1)海水淡化的方法有蒸馏法、___(任写一种)等,考虑成本及效益试剂①可选用___。
(2)比较溶液中Br2的浓度:溶液2___溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是__。
(4)从MgCl2溶液获得MgCl26H2O晶体的主要操作包括____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓是一种低熔点高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业;镓(Ga)与铝位于同一主族,金属镓的熔点是29.8℃,沸点是2403℃。
(1)工业上利用Ga(l)与NH3(g)在1000℃高温下合成半导体固体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.3 kJ热量。写出该反应的热化学方程式__________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
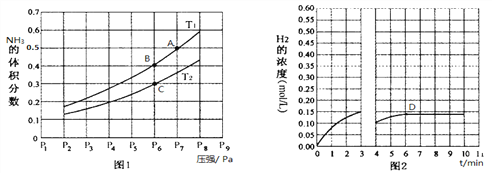
① 图1中A点和C点化学平衡常数的大小关系是:KA_____KC,(填“<”、“=”或“>”),理由是__________________________________________________。
② 该反应在T1和P6条件下至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(3~4 min的浓度变化未表示出来),则改变的条件为__________(仅改变温度或压强中的一种)。
(3)若用压强平衡常数Kp表示,此时B点对应的Kp=__________(用含P6的式子表示)(Kp为压强平衡常数,用平衡分压代替平衡浓度计算,气体平衡分压=总压×气体体积分数)
(4)电解精炼法提纯镓的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质。在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+。电解精炼镓时阳极泥的成分是_________。
②阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,写出GaO2-在阴极放电的电极反应式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如图所示。下列说法不正确的是
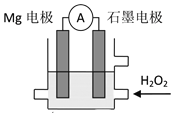
A.该电池正极的电极反应式:2H++H2O2+2e-=2H2O
B.石墨电极上发生还原反应
C.溶液中H+向石墨电极移动
D.电池工作时,电子从Mg电极经导线流向石墨电极,再由石墨电极经电解质溶液流向Mg电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用18mol/L的浓硫酸配制500mL 3mol/L的稀硫酸,下列说法正确的是( )
A.应用量筒量取83.30mL的浓硫酸
B.在烧杯中溶解后,应立即转移至容量瓶中
C.加水定容时,若俯视刻度线,会使所配溶液浓度偏低
D.若未洗涤烧杯内壁并将洗涤液转移至容量瓶中,会使所配溶液浓度偏低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com