
铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:填空题
为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是______;
(2)当有1 mol I2生成时,有________ mol还原剂被氧化;
(3)当有1 mol氧化剂参与反应时,转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化汽化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3、H2O七种物质。
(1)请用上述物质填空,并配平化学方程式:
(2)上述反应中氧化剂是(填化学式)_______________,被氧化的元素是(填元素符号)_____________。
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)____________________。
A.氧化性 B.酸性 C.氧化性和酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为________升。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
酒后驾车已成为一个社会问题。检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种。
(1)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:
3CH3CH2OH+2KMnO4→3CH3CHO+2MnO2+2KOH+2H2O 。
上述反应中发生还原反应的过程是________ →_________。
(2)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,溶液变蓝,乙醇被氧化为乙醛。该反应的化学方程式为_________。
(3)1994年美国首次批准使用唾液酒精含量检测方法,成为血液、呼气之后的第三种检测手段。其原理是在乙醇氧化酶作用下,乙醇与氧气反应生成乙醛和过氧化氢,判断该条件下乙醇、氧气、乙醛和过氧化氢四种物质中氧化性最强的物质是_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理以及燃料的开发与利用有重要意义。
(1)NO2可用水吸收,利用反应6NO2+8NH3 7N2+12H2O
7N2+12H2O
也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______________L。
(2)已知:2SO2(g)+ O2 (g)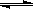 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 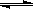 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) 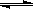 SO3 (g) +NO(g)的△H =______kJ·mol-1
SO3 (g) +NO(g)的△H =______kJ·mol-1
(3)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g) 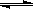 CH3OH (g)。由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
CH3OH (g)。由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
①该电池反应的总离子方程式为____________________________________________。
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____________(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的O2________________升。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
15.8gKMnO4与100mL12mol/L过量浓盐酸充分反应,化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl+5Cl2↑+8H2O,通过计算回答:
(1)产生的Cl2在标准状况下的体积为多少?
(2)有多少摩尔HCl被氧化?
(3)在反应后的溶液中加足量的AgNO3溶液可生成多少克沉淀?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(6分)在50mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)="3" mol·L-1。
(1)求稀释后的溶液的pH= 。
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1mol·L-1的NaOH恰好被吸收,求NaOH溶液的体积为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。
I.某兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)已知CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。
将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,B中有黑色物质生成。由此说明气体产物中含有 。
(2)将样品草酸亚铁晶体(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。
①试确定B点对应固体物质的化学式 ;
②写出B C对应的化学方程式 。
C对应的化学方程式 。
II.某草酸亚铁样品(不含结晶水)中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。
实验方案如下:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.02000 mol/L的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 ml。
试回答下列问题:
(1)高锰酸钾标准液用 滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为 。
(3)在步骤②中,下列操作会引起测定结果偏高的是 。
| A.滴定管在盛装高锰酸钾前未润洗 |
| B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出 |
| C.滴定前读数正确,滴定终点时俯视读数 |
| D.滴定前读数正确,滴定终点时仰视读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com