
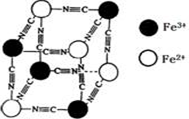
 分析化学中常用X射线研究晶体结构.
分析化学中常用X射线研究晶体结构.| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、KClO3被氧化 |
| B、氧化剂与还原剂之比为1:6 |
| C、氧化产物是Cl2 |
| D、HCl在化学反应中只能作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
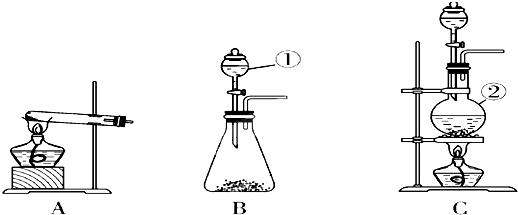
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 方法 |
| (1)提取草木灰中的K2CO3晶体; | |
| (2)提取沙砾中的碘 | |
| (3)碘水中提取碘; | |
| (4)氯化钠与氯化钾; | |
| (5)除去O2混有少量的CO2气体 | |
| (6)分离汽油和水; | |
| (7)除去生石灰中混有少量的碳酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com