
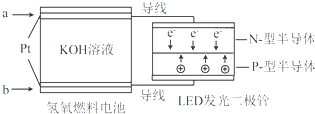
| A、a处通入O2 |
| B、b处为电池正极,发生了还原反应 |
| C、通入O2的电极发生反应:O2+4e-+4H+=2H2O |
| D、该装置将化学能最终转化为电能 |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
| A、物质B的质量分数增大了 |
| B、物质A的转化率减小了 |
| C、平衡向逆反应方向移动了 |
| D、a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.l mol?L-l CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ |
| B、Na2CO3溶液能使酚酞试液变红:CO32-+H2O?HCO3-+OH- |
| C、铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-?3Fe2++2NO↑+4H2O |
| D、向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀:3Mg(OH)2(s)+2Fe3+(aq)?2Fe(OH)3(s)+3Mg2+(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| D |
| ① |
| D |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 是一种白色晶体,其酸及盐均为强氧化剂.
是一种白色晶体,其酸及盐均为强氧化剂.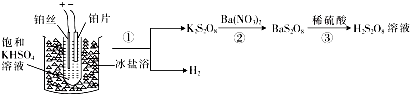
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝 | 证明溶液中有NH4+ |
| B | 向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 | 证明该溶液中存在SO32- |
| C | 将Cl2通入品红溶液中,品红溶液褪色 | 证明Cl2的还原性 |
| D | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com