


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
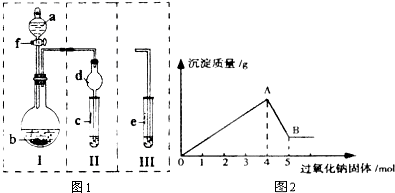
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,铜与氧气很难反应,因为铜和氧气的反应是吸热反应 |
| B、金属锂在常温和加热情况下与氧气反应的产物不同 |
| C、焰色反应实验中的铂丝应用稀盐酸洗涤 |
| D、用pH试纸测得某浓度氯水的pH为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
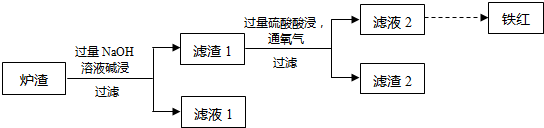
查看答案和解析>>
科目:高中化学 来源: 题型:
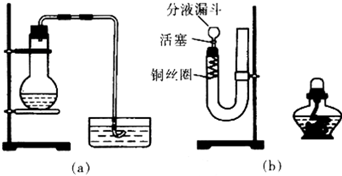
查看答案和解析>>
科目:高中化学 来源: 题型:
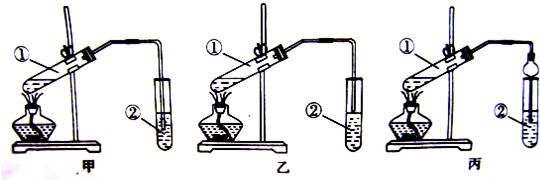
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com