
|
LiBH4是储氢材料,其释放氢气的原理为2LiBH4→2LiH+2B+3H2↑.下列说法正确的是 | |
| [ ] | |
A. |
B与Al同主族,均为金属元素 |
B. |
LiBH4中B的化合价是-3 |
C. |
Li+的离子半径小于H-的离子半径 |
D. |
LiBH4释放氢气和从储氢钢瓶中释放氢气原理相同 |
科目:高中化学 来源: 题型:
 (2013?临沂三模)[化学--物质结构与性质]
(2013?临沂三模)[化学--物质结构与性质]| 52 |
| a.NA |
| 52 |
| a.NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| I1/kJ?mol-1 | I2/kJ?mol-1 |
I3/kJ?mol-1 |
I4/kJ?mol-1 |
I5/kJ?mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省毕业班质量检查理综考试化学试卷(解析版) 题型:填空题
开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4—构成,BH4—呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
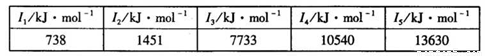
M是______(填元素符号)。
(3)某种新型储氢材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
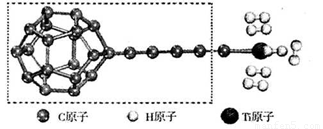
(4)分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是______(填标号)。
A.H2O B.CH4 C.HF D.CO(NH2)2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com