
分析 在一定条件下,向体积为2L的容器中加入3mol O2和3mol SO2,2min时测得O2的物质的量为1.6mol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):3 2 0
变化量(mol):0.8 0.4 0.8
2min时(mol):2.2 1.6 0.8
(1)根据v=$\frac{△c}{△t}$计算v(SO3);
(2)根据c=$\frac{n}{V}$计算2min时SO2的浓度.
解答 解:在一定条件下,向体积为2L的容器中加入2mol O2和3mol SO2,2min时测得O2的物质的量为1.6mol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):3 2 0
变化量(mol):0.8 0.4 0.8
2min时(mol):2.2 1.6 0.8
(1)2min内,平均反应速率v(SO3)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/(L.min),
答:2min内,平均反应速率v(SO3)=0.2mol/(L.min);
(2)2min时SO2的浓度为$\frac{2.2mol}{2L}$=1.1mol/L,答:2min时SO2的浓度为1.1mol/L.
点评 本题考查化学平衡计算、反应速率计算,比较基础,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:| 本题中出现有机物相关数据 | |||
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B)=0.25 mol•L-1•s-1 | B. | C的体积分数为30% | ||
| C. | B的转化率为25% | D. | n=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K2=125,1 000 s时N2O5转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
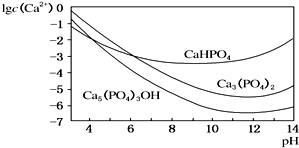 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L | B. | 2L | C. | 3L | D. | 2.8 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com