
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
分析 根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据Cu2+离子的浓度计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值.
解答 解:某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥$\sqrt{\frac{2×1{0}^{-14}}{0.02}}$mol/L=10-9mol/L,则c(H+)≤$\frac{1×1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,
所以pH≥-lg(10-5)=5,所以应调节pH大于5,
故选D.
点评 本题考查溶度积常数的计算,题目难度不大,注意把握计算公式的运用.


科目:高中化学 来源: 题型:选择题
| A. | 工业合成氯化氢时使用过量氢气 | |
| B. | 实验室制备乙酸丁酯时使用过量乙酸 | |
| C. | 加热蒸干氯化铁的溶液,得到氢氧化铁固体 | |
| D. | 氯化银悬浊液中加入硫化钠溶液,产生黑色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
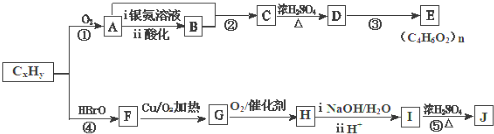

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个转化中只有一个涉及氧化还原反应 | |
| B. | 第二步离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+ | |
| C. | 处理含铬废水可使用强碱Ba(OH)2,也可以使用弱碱氨水 | |
| D. | 当pH≥5时,废水中铬元素沉淀完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胃舒平(主要含氢氧化铝)治疗胃酸过多:OH-+H+═H2O | |
| B. | 醋酸除水垢:2H++CaCO3═Ca2++H2O+CO2↑ | |
| C. | 敞口的澄清石灰水变质:Ca2++2OH-+2CO2═Ca(HCO3)2 | |
| D. | 稀盐酸除铁锈:6H++Fe2O3═2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

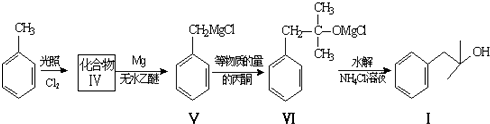
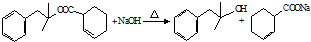 .
.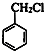 ,生成化合物Ⅳ的反应类型为取代反应.
,生成化合物Ⅳ的反应类型为取代反应.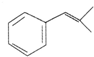 或
或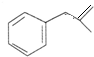 .
. 也能发生类似Ⅴ→Ⅵ的反应生成化合物Ⅶ,则Ⅶ的结构简式为
也能发生类似Ⅴ→Ⅵ的反应生成化合物Ⅶ,则Ⅶ的结构简式为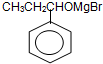 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X单质最稳定 | B. | Y的氢化物为HY | ||
| C. | Z单质常温下是淡黄色固体 | D. | 能生成HXO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com